Regulation molekularer "Anstandsdame" aufgeklärt
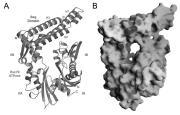
Struktur des Chaperon-Regulator-Komplexes.
Für Sitte und Anstand im Reich der Moleküle sorgt eine Gruppe von Eiweißen, die Wissenschaftler als „Chaperone“ (englisch für „Anstandsdamen“) bezeichnen. Sie verhindern, dass Zellproteine „unziemliche“ Beziehungen mit anderen Proteinen eingehen und dadurch unter Umständen ihre Rolle in der Zelle nicht mehr erfüllen können. Chaperone scheinen so auch den Verlauf von Erkrankungen wie beispielsweise der Huntington’schen Krankheit zu beeinflussen. Forscher am Max-Planck-Institut für Biochemie und am Institut für Zellbiologie der Universität Bonn haben nun herausgefunden, wie die Funktion einer solchen molekularen Anstandsdame reguliert wird. Die Ergebnisse wurden am 23. Februar in der Wissenschaftszeitschrift Science veröffentlicht.
Eiweiße oder Proteine sind Hauptbestandteile der lebenden Zelle. Sie sind aus einer Kette von Aminosäuren aufgebaut, die in einem Faltungsvorgang eine bestimmte räumliche Struktur annehmen muss. Diese Struktur bestimmt dann letztlich die Funktion der Proteine. In den letzten Jahren konnte gezeigt werden, dass an dem Faltungsvorgang in der Zelle Helferproteine, die Chaperone, beteiligt sind. Sie verhindern eine Fehlfaltung, indem unerwünschte Kontakte zu anderen Proteinen unterbunden werden.
Wie wichtig die korrekte dreidimensionale Struktur für die Funktion eines Proteins ist, verdeutlicht beispielsweise die BSE-Erkrankung: Nach heutigem Kenntnisstand nehmen bei dieser Krankheit gewisse Eiweiße in den Nervenzellen des Gehirns plötzlich eine falsche Struktur an, wodurch sie nicht mehr abgebaut werden können. Statt dessen reichern sie sich an und lassen die Nervenzelle absterben. Auch für die Huntington-Erkrankung ist eine Fehlfaltung der Proteine die Ursache. Die Aufklärung der Funktion und Regulation von molekularen Chaperonen ist daher von großem medizinischen Interesse.
Die Arbeitsgruppe des Bonner Wissenschaftlers Prof. Dr. Jörg Höhfeld hat nun in Zusammenarbeit mit dem Labor von Prof. F.-Ulrich Hartl und Dr. Ismail Moarefi am Max-Planck-Institut für Biochemie in Martinsried entscheidende Einblicke in die Regulation des Chaperons Hsp70 gewonnen. Den Forschern gelang es, einen Komplex aus dem Hsp70 mit einem Regulatorprotein zu kristallisieren und seine dreidimensionale Struktur aufzuklären. Die Untersuchungen, deren Ergebnisse in der renommierten Wissenschaftszeitschrift Science vom 23. Februar publiziert wurden, zeigen auf molekularer Ebene, wie das Regulatorprotein die Aktivität von Hsp70 beeinflusst. Interessanterweise wurde ein ähnlicher Regulationsmechanismus auch in Bakterien beobachtet, der dort aber von einem gänzlich anderen Regulatorprotein vermittelt wird.
Als nächsten Schritt sieht Höhfeld die gezielte Veränderung der zellulären Funktion von Hsp70. Auf diese Weise solle es möglich sein, auch auf humane Erkrankungen, denen eine Proteinfehlfaltung zugrunde liegt, Einfluss zu nehmen.
Weitere Informationen: Prof. Dr. Jörg Höhfeld, Tel.: 0228/73-5308, E-Mail: hoehfeld@uni-bonn.de
Weitere Informationen finden Sie im WWW:
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















