Proteinkristalle in einem anderen Licht
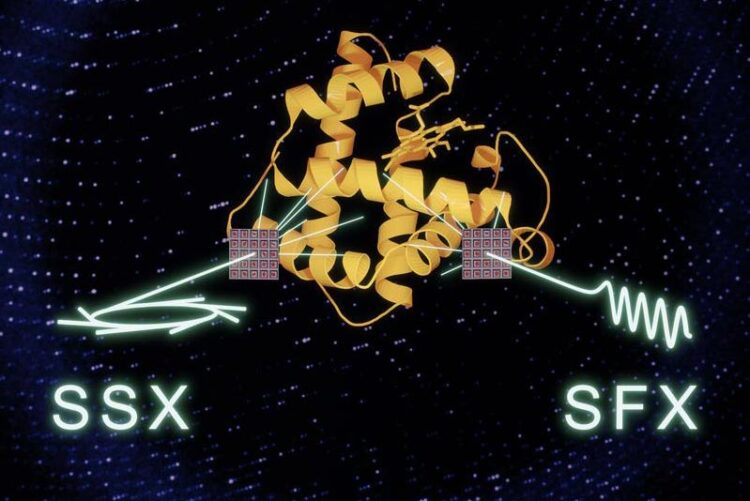
Ein systematischer Vergleich zeigt, dass Synchrotrons und XFELs Daten von gleichwertiger Qualität erzeugen. Dies eröffnet neue Wege für kollaborative Anwendungen, um beide Strahlungsquellen für die Erforschung der biomolekularen Dynamik zu nutzen
Jörg Harms / MPSD
Ein Forschungsteam des MPSD (Max-Planck-Institut für Struktur und Dynamik der Materie) am Center for Free-Electron Laser Science in Hamburg, der Universität Toronto (Kanada), der Diamond Light Source in Oxford (UK) und des EMBL (European Molecular Biology Laboratory) in Hamburg hat entdeckt, dass zwei der hellsten Lichtquellen der Welt mehr gemeinsame Forschungsmöglichkeiten bieten als bislang angenommen. Obwohl sie auf sehr unterschiedlichen Zeitskalen arbeiten, können Synchrotrons und XFELs Daten von gleichwertiger Qualität erzeugen, solange bei der Bildgebung eine serielle Datenerfassung und Kristalle gleicher Größe verwendet werden. Die Arbeit ist in Science Advances erschienen.
Das Leben und seine molekularen Bausteine sind dynamisch. Die Bewegungen und strukturellen Veränderungen von Biomolekülen bestimmen ihre Funktion. Diese dynamischen Bewegungen auf molekularer Ebene zu verstehen, ist jedoch eine gewaltige Herausforderung. Jahrzehntelang haben sich Forscher auf die Röntgenstrahlung von mehr als fünfzig Synchrotronlichtquellen weltweit verlassen und Proteinkristalle verwendet, um die molekulare Architektur der Bausteine des Lebens zu untersuchen.
In den letzten Jahren wurde eine neue Generation von Röntgenlichtquellen entwickelt, um selbst die schnellsten Bewegungen in Proteinen zu erforschen: Die Röntgen-Freie-Elektronen-Laser (XFEL). Einzigartig an diesen ultrahellen Lichtquellen ist, dass sie Schnappschüsse der Proteindynamik innerhalb von Bruchteilen einer Billionstelsekunde einfangen können. Allerdings zerstören ihre Lichtpulse dabei die Proteinkristalle, so dass mehrere Tausend untersucht werden müssen, um eine vollständige Struktur zu erhalten – im Gegensatz zur kanonischen Strukturbestimmung an Synchrotrons, bei der nur ein einziger Kristall verwendet wird. Bei XFELs wird daher jeder Kristall nur einmal dem Röntgenstrahl ausgesetzt und schnell durch einen neuen ersetzt. Dieser Prozess ist als serielle Datenerfassung bekannt.
Um zu verstehen, wie sich eine Proteinstruktur während eines Prozesses verändert, wird eine Reaktion in den Kristallen ausgelöst, die anschließend nach definierten Verzögerungszeiten den extrem hellen XFEL-Pulsen ausgesetzt werden. Diese Schnappschüsse lassen sich dann zu einer Bildserie zusammensetzen, welche Einblicke in die Dynamik selbst der schnellsten Prozesse des Lebens gibt – von der Fixierung des Kohlendioxids bis zur Wasserspaltungsreaktion bei der Photosynthese und den Vorgängen beim menschlichen Sehen. Allerdings sind derzeit weltweit nur sieben XFELs in Betrieb, was den allgemeinen Zugang erschwert und die Nutzung auf spezialisierte Gruppen beschränkt.
Der Großteil der Proteinreaktionen ist jedoch in etwa einer Zehntelsekunde abgeschlossen, also nur einem Wimpernschlag – ein Schneckentempo im Vergleich zu den oben genannten ultraschnellen Beispielen. Dies ist durchaus in der Reichweite der weitaus zugänglicheren Synchrotrons, die routinemäßig Einblicke in bis zu tausendfach schnellere Prozesse liefern können.
Sind die auf solch unterschiedlichen Zeitskalen erreichten Ergebnisse dann wirklich vergleichbar? Die Arbeit des Teams bestätigt dies – solange serielle Datenerfassung und Kristalle ähnlicher Größe im Abbildungsprozess an beiden Arten von Lichtquellen verwendet werden. Bei XFELs ist diese Methode entscheidend, weil die Proben durch die Einwirkung der Röntgenstrahlen zerstört werden. Aber auch bei Synchrotrons minimiert der Einsatz der seriellen Datenerfassung die Strahlenschäden und liefert Ergebnisse von gleichwertiger Qualität, wie diese Studie belegt.
Basierend auf diesem wichtigen Ergebnis können Wissenschaftler*innen umfassende Fragestellungen bearbeiten, indem sie die wesentlichen Stärken beider Lichtquellen kombinieren. Mit anderen Worten: Die schnellste Dynamik kann an hochspezialisierten XFELs und die langsamere Dynamik an breiter verfügbaren Synchrotrons angegangen werden.
Die Kombination beider Lichtquellen sollte so den Bereich der biomolekularen Dynamik erweitern. Dies würde auch die weitere detaillierte Erforschung der Funktionsweise von gesundheitsrelevanten Proteinen ermöglichen, einschließlich solcher, die eine Schlüsselrolle bei Infektionskrankheiten wie SARS-CoV2 oder bei pathogenen, antibiotikaresistenten Bakterien spielen. Letztendlich werden diese grundlegenden neuen Erkenntnisse es den Wissenschaftlern ermöglichen, in Zukunft bessere Behandlungsmethoden für eine Vielzahl von Erkrankungen zu entwickeln.
Wissenschaftliche Ansprechpartner:
Pedram Mehrabi, Erstautor: Pedram.mehrabi@mpsd.mpg.de
Originalpublikation:
https://advances.sciencemag.org/content/7/12/eabf1380
Weitere Informationen:
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…