HIV: Erbgut-Schmuggel in den Zellkern
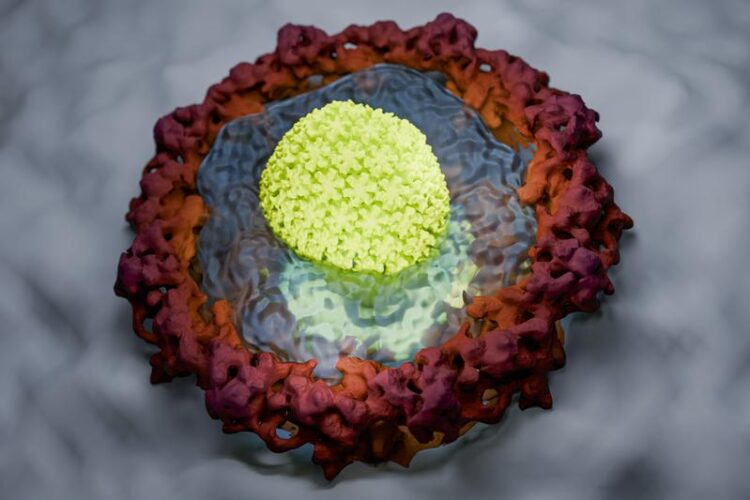
Künstlerische Darstellung, wie das HIV-Kapsid die Gelee-artige Permeabilitätsbarriere einer Kernpore durchdringt. Um sein Genom durch diese Verteidigungslinie in den Zellkern zu schmuggeln, hat es sich zu einem molekularen Transporter entwickelt.
(c) Johannes Pauly / Max-Planck-Institut für Multidisziplinäre Naturwissenschaften
Über eine Million Menschen stecken sich jährlich mit dem AIDS-Virus HIV an. Um eine Wirtszelle zu infizieren und sich zu vermehren, muss das Virus sein Erbgut in den Zellkern schleusen und in ein Chromosom einbauen. Teams um Dirk Görlich am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften und Thomas Schwartz am Massachusetts Institute of Technology (MIT) haben jetzt entdeckt, dass sich das Kapsid des Virus zu einem molekularen Transporter entwickelt hat. Dieser kann eine zentrale Verteidigungslinie des Zellkerns direkt durchqueren, die sonst vor eindringenden Viren schützt. Für die anti-viralen Sensoren im Zytoplasma bleibt das HIV-Genom bei diesem Schmuggel quasi unsichtbar.
Auch 40 Jahre nach der Entdeckung des Humanen Immundefizienz-Virus (HIV) als Auslöser von AIDS gibt es zwar Therapien, die das Virus wirksam unter Kontrolle halten, aber noch keine wirkliche Heilung. Um sich zu vermehren, infiziert das Virus bestimmte Immunzellen und kapert deren genetisches Programm, um sein eigenes Erbgut zu vervielfältigen. Die Immunzellen produzieren dann die nächste Virusgeneration, bis sie schließlich selbst zerstört werden. Der massive Verlust von Immunzellen, die eigentlich der Abwehr von Viren und anderen Krankheitserregern dienen, führt schließlich zum AIDS-typischen Immundefekt.
Um die Ressourcen seiner Wirtszelle zu nutzen, muss das HIV sein Erbgut durch zelluläre Verteidigungslinien in den Zellkern schmuggeln. Letzterer ist streng bewacht. Seine Kernhülle verhindert, dass sich Proteine oder Viren unerwünscht aus dem Zytoplasma Zutritt verschaffen oder Moleküle den Zellkern unkontrolliert verlassen. Die Barriere riegelt dabei nicht hermetisch ab; benötigte Proteine können passieren.
Den nötigen Durchlass ermöglichen einige tausend winziger Kernporen in der Zellkernhülle, die trickreiche Mechanismen zur Einlasskontrolle nutzen. Spezielle molekulare Transporter, sogenannte Importine und Exportine, erkennen ihre Fracht anhand eines molekularen Passierscheins und befördern sie dann durch den Kernporenkanal. Ein „intelligentes“ Material im Herzen des Kernporenkomplexes macht diesen dabei zu einer der effizientesten Sortier- und Transportmaschinen der Natur.
„Intelligentes“ Sortieren in der Kernpore
Dieses Gelee-artige Material, die sogenannte FG-Phase, ist für die meisten Makromoleküle sehr undurchdringbar. Es wirkt als Barriere, die den Kernporenkanal ausfüllt und blockiert. Importine und Exportine können aber mühelos hindurchgleiten, weil ihre Oberflächen für die Passage durch eine FG-Phase optimiert sind.
Die zelluläre Grenzkontrolle in der FG-Phase erfolgt sehr schnell – innerhalb von Millisekunden. Auch die Transportkapazität ist enorm: Eine einzelne Kernpore kann bis zu 1.000 Transporter pro Sekunde durch ihren Kanal schleusen. Selbst bei so hoher Verkehrsdichte bleibt die Barriere der Kernpore intakt und kann unerwünschten Grenzverkehr verhindern. Doch das HI-Virus hebelt die Kontrolle auf perfide Weise aus.
Eingeschmuggeltes Erbgut
„HIV verpackt sein Genom in eine große kegelförmige Struktur, das sogenannte Kapsid. Neuere Experimente deuten darauf hin, dass das virale Erbgut dort verbleibt, bis es die Kernpore passiert hat und im Kern angekommen ist. Dabei gibt es aber ein Größenproblem“, sagt Thomas Schwartz vom MIT. Das HIV-Kapsid ist etwa 60 Nanometer (millionstel Millimeter) breit. Der Durchmesser des Kernporenkanals beträgt 40 bis maximal 60 Nanometer. Damit könnte sich das Kapsid allein gerade noch so durch die Kernpore zwängen. Würde es aber wie normale Zellfracht transportiert, müsste es noch von einer Transporter-Schicht umhüllt sein, die mindestens weitere zehn Nanometer misst. Mit dieser Schicht wäre das HIV-Kapsid 70 Nanometer breit – zu groß für eine Kernpore. „Von elektronenmikroskopischen Untersuchungen wissen wir aber, dass das HIV-Kapsid dennoch in das Innere einer Kernpore gelangt. Wie es dort hineinpasst, war bisher ein ungelöstes Rätsel“, erklärt Max-Planck-Direktor Görlich.
Das Kapsid als molekularer Transporter
Zusammen mit Schwartz hat er nun entdeckt, dass das Virus sein Größenproblem durch eine raffinierte molekulare Anpassung gelöst hat. „Das HIV-Kapsid hat sich zu einem Transporter mit einer Importin-artigen Oberfläche entwickelt. Damit kann es leicht durch die blockierende Barriere ins Innere der Kernpore gleiten, ohne auf helfende Transporter angewiesen zu sein. Mit diesen Tricks umgeht das Kapsid einen zentralen Schutzmechanismus, der eigentlich verhindern soll, dass Viren in den Zellkern eindringen“, berichtet der Biochemiker.
Görlichs Team ist es gelungen, FG-Phasen im Labor nachzubauen. „Sie erscheinen unter dem Mikroskop als mikrometergroße Kügelchen, die normale Proteine vollständig ausschließen, das HIV-Kapsid samt Inhalt aber quasi einsaugen“, schildert Liran Fu, eine der Erstautor*innen der jetzt im Fachmagazin Nature erschienenen Studie. „Genauso wird das Kapsid in den eigentlichen Kernporenkanal hineingesogen. Das passiert auch noch, wenn zuvor sämtliche Transporter der Zelle entfernten wurden.“
Bei aller Ähnlichkeit mit den zelleigenen Transportern unterscheidet sich das HIV-Kapsid in einem Detail grundlegend von allen bisher untersuchten Transporterklassen. Es kapselt seine Fracht vollständig ein und verbirgt so das transportierte Erbgut vor anti-viralen Sensoren im Zytoplasma. Quasi unsichtbar kann das virale Genom so durch die zelluläre Virusabwehr geschmuggelt werden, ohne erkannt und zerstört zu werden. „Das HIV-Kapsid ist damit, nach den Importinen und Exportinen, eine ganz neue Klasse von molekularen Transportern“, so Görlich.
Wie das Virus-Erbgut schließlich aus dem Kapsid freigesetzt wird, ist noch unklar. Ob das Kapsid dafür tiefer in den Zellkern eindringt, ob es schon in der Nähe oder innerhalb des Kanals zerfällt und welche Faktoren dabei eine Rolle spielen, müssen weitere Experimente zeigen.
Die Erkenntnis, dass das Kapsid die FG-Phase direkt durchquert, könnte in Zukunft für bessere AIDS-Therapien ausgenutzt werden.
Wissenschaftliche Ansprechpartner:
Prof. Dr. Dirk Görlich
Abteilung Zelluläre Logistik
Max-Planck-Institut für Multidisziplinäre Naturwissenschaften, Göttingen
Tel.: +49 551 201-2400
E-mail: goerlich@mpinat.mpg.de
Originalpublikation:
Fu, L.; Weiskopf, E. N.; Akkermans, O.; Swanson, N. A.; Cheng, S.; Schwartz, T. U.; & Görlich, D.: HIV-1 capsids enter the FG phase of nuclear pores like a transport receptor. Nature, 24. Januar 2024.
https://doi.org/10.1038/s41586-023-06966-w
Weitere Informationen:
https://www.mpinat.mpg.de/4608728/pr_2403 – Original-Pressemitteilung
https://www.mpinat.mpg.de/de/goerlich – Webseite der Abteilung Zelluläre Logistik, Max-Planck-Institut für Multidisziplinäre Naturwissenschaften, Göttingen
Media Contact
Alle Nachrichten aus der Kategorie: Interdisziplinäre Forschung
Aktuelle Meldungen und Entwicklungen aus fächer- und disziplinenübergreifender Forschung.
Der innovations-report bietet Ihnen hierzu interessante Berichte und Artikel, unter anderem zu den Teilbereichen: Mikrosystemforschung, Emotionsforschung, Zukunftsforschung und Stratosphärenforschung.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…