Röntgenblitze entschlüsseln Struktur von Virus-Kokon
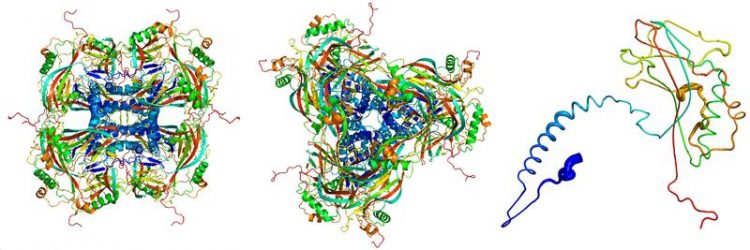
Struktur der Bausteine des Viruskokons (links und Mitte) sowie des Einzelproteins Granulin (rechts), berechnet aus der Röntgenstrukturanalyse. Dominik Oberthür, CFEL/DESY
„Das Granulovirus befällt bestimmte Insekten und tötet sie. Da es dann mit seinem toten Wirt zunächst an Ort und Stelle liegenbleibt, muss es sich – manchmal jahrelang – vor Umwelteinflüssen wie Hitze, UV-Licht und Trockenheit schützen, bis es irgendwann wieder von einem Insekt aufgenommen wird. Deshalb hüllt sich das Virus in einen Kokon aus Proteinkristallen, der sich erst im Insektendarm wieder auflöst“, erläutert Dr. Cornelius Gati von DESY, Hauptautor der wissenschaftlichen Veröffentlichung.
Diese Viren sind das Spezialgebiet von Prof. Peter Metcalf von der Universität Auckland in Neuseeland und Prof. Johannes Jehle vom Julius-Kühn-Institut in Darmstadt, deren Gruppen an der Studie beteiligt sind. Die Forscher untersuchten den Kokon eines Granulovirus (CpGV), das in der Landwirtschaft als biologisches Schädlingsbekämpfungsmittel gegen die Raupen des Apfelwicklers Cydia pomonella eingesetzt wird. Für Menschen sind diese Viren ungefährlich.
Forscher interessieren sich für die räumliche Struktur von Proteinen und anderen Biomolekülen, weil sich dadurch deren Funktionsweise erschließen lässt. Daraus hat sich ein eigener Wissenschaftszweig entwickelt, die Strukturbiologie. „In den vergangenen 50 Jahren haben Wissenschaftler mehr als 100 000 Proteinstrukturen entschlüsselt“, betont Chapman, der auch Physikprofessor an der Universität Hamburg ist. „Das mit Abstand wichtigste Werkzeug dabei ist die Röntgenkristallographie.“
Bei dieser Methode wird ein Kristall aus dem zu untersuchenden Protein gezüchtet und mit hellem Röntgenlicht beleuchtet. Es entsteht ein charakteristisches Muster der gebeugten Röntgenstrahlen, aus dem sich die räumliche Struktur des untersuchten Kristalls und seiner Bausteine berechnen lässt.
„Eine große Herausforderung bei diesem Verfahren ist allerdings die Kristallzucht“, sagt Chapman. Viele Proteine lassen sich nur widerwillig in Kristallform zwingen, weil es nicht ihrem natürlichen Zustand entspricht. Je kleiner die Kristalle für die Untersuchung sein dürfen, desto eher gelingt zwar häufig die Zucht, desto schwieriger ist jedoch auch die Untersuchung. „Wir hoffen, in Zukunft sogar ganz auf die Kristallzucht verzichten und einzelne Moleküle direkt per Röntgenlicht untersuchen zu können. Daher möchten wir verstehen, wo die Grenzen liegen“, sagt Chapman.
„Die eiförmigen Okklusionskörper des Granulovirus sind die kleinsten Proteinkristalle, die je für die Röntgen-Strukturanalyse benutzt worden sind“, erläutert Gati. Diese Virus-Kokons haben ein Volumen von etwa 0,01 Kubik-Mikrometer, das ist rund Hundert Mal weniger als die kleinsten künstlich gezüchteten Proteinkristalle, die bislang mit der Kristallographie analysiert werden konnten.
Je kleiner ein Kristall ist, desto heller muss das Röntgenlicht sein, mit dem er beleuchtet wird, um ein ausreichend detailliertes Streubild aufnehmen zu können. Die intensivsten Röntgenblitze erzeugen sogenannte Freie-Elektronen-Laser, in denen ein Strahl extrem schneller Elektronen durch eine magnetische Slalomstrecke gelenkt wird und dabei laserartiges Röntgenlicht aussendet.
Die Wissenschaftler nutzten für ihre Untersuchungen den Freie-Elektronen-Laser LCLS am US-Forschungszentrum SLAC in Kalifornien und fokussierten seine Röntgenpulse mit einer Spezialoptik auf eine Größe, die dem Durchmesser eines Viruspartikels entspricht. „Wenn man die geballte Kraft des Röntgenlasers komplett auf ein winziges Virus fokussiert, bekommt es eine enorme Strahlungsdosis“, berichtet Gati, der heute am SLAC arbeitet. Die Dosis lag bei 1,3 Milliarden Gray. Zum Vergleich: Die tödliche Dosis für Menschen liegt bei etwa 50 Gray.
Die Röntgenstrahlungsdosis war auch für die Viruskristalle vernichtend – sie verdampften in den Blitzen. Allerdings sind die Blitze so kurz, dass sie die Strukturinformation des unbeschädigten Kristalls zum Detektor befördern, bevor das Viruspartikel explodiert. Die Analyse der aufgezeichneten Streubilder zeigt, dass selbst die winzigen Proteinkristalle trotz der extrem hohen Strahlungsdosis auf diese Weise ihre Struktur in atomarer Auflösung preisgeben.
„Simulationen auf Grundlage unserer Messungen ergeben, dass wir mit unserer Methode voraussichtlich selbst die Struktur von noch kleineren Kristallen aus lediglich einigen hundert oder tausend Molekülen entschlüsseln könnten“, berichtet Chapman, der auch Mitglied im Hamburger Center for Ultrafast Imaging (CUI) ist. „Damit schaffen wir einen großen Schritt in Richtung unseres Ziels, der Analyse von Einzelmolekülen.“
An der Studie waren auch die European XFEL GmbH in Schenefeld, das Max-Planck-Institut für medizinische Forschung in Heidelberg, die Arizona State University (USA) und die Universität Basel (Schweiz) beteiligt.
Das Deutsche Elektronen-Synchrotron DESY ist das führende deutsche Beschleunigerzentrum und eines der führenden weltweit. DESY ist Mitglied der Helmholtz-Gemeinschaft und wird zu 90 Prozent vom BMBF und zu 10 Prozent von den Ländern Hamburg und Brandenburg finanziert. An seinen Standorten in Hamburg und Zeuthen bei Berlin entwickelt, baut und betreibt DESY große Teilchenbeschleuniger und erforscht damit die Struktur der Materie. Die Kombination von Forschung mit Photonen und Teilchenphysik bei DESY ist einmalig in Europa.
Originalveröffentlichung
Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser; Cornelius Gati et al.
„PNAS”, 2017; DOI: 10.1073/pnas.1609243114
http://www.desy.de/aktuelles/news_suche/index_ger.html?openDirectAnchor=1174&… – Pressemtteilung mit Bildmaterial
Media Contact
Alle Nachrichten aus der Kategorie: Physik Astronomie
Von grundlegenden Gesetzen der Natur, ihre elementaren Bausteine und deren Wechselwirkungen, den Eigenschaften und dem Verhalten von Materie über Felder in Raum und Zeit bis hin zur Struktur von Raum und Zeit selbst.
Der innovations report bietet Ihnen hierzu interessante Berichte und Artikel, unter anderem zu den Teilbereichen: Astrophysik, Lasertechnologie, Kernphysik, Quantenphysik, Nanotechnologie, Teilchenphysik, Festkörperphysik, Mars, Venus, und Hubble.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















