Das große Fressen: Mainzer Wissenschaftler identifizieren neuen Faktor der Autophagie

„Der nur 1 mm große, durchsichtige Fadenwurm Caenorhabditis elegans zeichnet sich unter anderem durch eine kurze Generationszeit und genau festgelegte Zellzahl aus und dient als Modellorganismus Dr. Andreas Kern, Institut für Pathobiochemie der Universitätsmedizin Mainz
Der Arbeitsgruppe um Univ.-Prof. Dr. Christian Behl vom Institut für Pathobiochemie der Universitätsmedizin Mainz ist es jetzt gelungen, mit dem sogenannten RAB3GAP-Komplex einen neuen Faktor zu identifizieren, der den Abbau von Proteinen beeinflusst. Die Wissenschaftler konnten ihn der Autophagie zuordnen, einem Prozess, in dem die Zelle eigene Bestandteile in ihre Komponenten zerlegt, um sie unschädlich zu machen und wiederzuverwerten.
Aus den Erkenntnissen ergeben sich neue Ansatzpunkte, um therapeutische und präventive Konzepte gegen neurodegenerative Erkrankungen entwickeln zu können. Ihre Forschungsergebnisse hat die Arbeitsgruppe jetzt in der Fachzeitschrift „Autophagy“ veröffentlicht.
Das Team um Professor Behl und Dr. Andreas Kern konnte zeigen, dass der RAB3GAP-Komplex den Abbauprozess von Proteinen entscheidend beeinflusst, indem er einen bedeutenden Faktor des zellulären Autophagie-Netzwerks darstellt. Autophagie (abgeleitet von den griechischen Begriffen für „selbst“ und „fressen“) bezeichnet einen Prozess, bei dem die Zelle eigene Bestandteile „verdaut“ – dies können überzählige oder geschädigte Organellen wie Mitochondrien sein, eingedrungene Erreger (Viren, Bakterien) oder zytoplasmatische Makromoleküle.
Die Autophagie dient zum einen dem „Recycling“ von Zellbausteinen und dem Energiegewinn, wird aber auch gezielt in Stresssituationen aktiviert. „Der kontrollierte Proteinabbau durch die Autophagie ist eine zentrale Säule der Proteinhomöostase, des komplexen Zusammenspiels von Synthese, Faltung und Abbau von Proteinen. Indem wir neue Faktoren dieses Prozesses identifiziert haben, konnten wir unser Verständnis für altersabhängige Störungen erweitern“, stellt Professor Behl fest.
Konkret fanden die Pathobiochemiker heraus, dass der RAB3GAP-Komplex die Bildung autophagischer Vesikel unterstützt. Dabei handelt es sich um Bläschen mit einer Lipid (Fett)-Hülle, die die abzubauenden Substrate in ihr Inneres einschließen. Die autophagischen Vesikel verschmelzen dann mit Lysosomen, einfachen Zellorganellen, die Verdauungsenzyme enthalten und die Substrate in ihre Bestandteile zerlegen.
„Damit sich autophagische Vesikel bilden können, braucht es Lipidmembranen, deren Verfügbarkeit die Zelle gewährleisten muss. Unsere Entdeckung legt nahe, dass der RAB3GAP-Komplex Lipide rekrutiert, die für den Abbau von Proteinen mittels Autophagie benötigt werden“, sagt Dr. Andreas Kern vom Institut für Pathobiochemie, der die Experimente federführend leitete.
Bislang war nur bekannt, dass der RAB3GAP-Komplex für die Regulation der RAB GTPase RAB3 wichtig ist und den Vesikeltransport an den Kontaktstellen zwischen den Nervenzellen, den Synapsen, beeinflusst. Die nun aufgezeigte duale Funktionalität des Komplexes ist besonders im Hinblick auf Erkrankungen des Nervensystems von besonderer Bedeutung.
Die Entdeckung der Mainzer Wissenschaftler basiert auf Experimenten mit dem Fadenwurm C. elegans, der als vereinfachtes Modell u.a. für das menschliche Nervensystem herangezogen wird. In C. elegans haben die Biochemiker circa 2.500 Gene mittels spezieller molekularbiologischer Methoden gezielt einzeln ausgeschaltet und die Effekte auf die Proteinaggregation analysiert. Den Wissenschaftlern gelang es so, zahlreiche Gene zu identifizieren, deren „Abschalten“ zu einer verstärkten Proteinablagerung führte. Die genaue Analyse der Funktion erfolgte dann in humanen Kulturzellen.
Die Arbeitsgruppe von Professor Behl konnte zudem zeigen, dass die positive Modulation der Autophagie durch den RAB3GAP-Komplex einem bereits bekannten negativen Autophagie-Regulator entgegenwirkt. „Unsere Hypothese ist, dass die Balance der beiden entgegengesetzt wirkenden Moleküle die autophagische Gesamtaktivität von Zellen bestimmt. Wir glauben, dass wir nicht nur dem Verständnis des Prozesses der Autophagie näher gekommen sind. Vielmehr sehen wir die Chance, mit seiner gezielten Modulation neue Ansatzpunkte für die Therapie und die Prävention neurodegenerativer Erkrankungen entwickeln zu können“, so Professor Behl.
An dem langjährigen Forschungsprojekt waren neben den Mainzer Wissenschaftlern auch Biochemiker der Goethe-Universität Frankfurt beteiligt. Es wurde auf breiter Ebene von der Alzheimer Forschung Initiative e.V., der Deutschen Forschungsgemeinschaft – unter anderem im Rahmen des Sonderforschungsbereichs „Molekulare und zelluläre Mechanismen neuronaler Homöostase“ (SFB 1080) –, dem Europäischen Forschungsrat und mehreren Stiftungen unterstützt.
Originalpublikation:
Spang N, Feldmann A, Huesmann H, Bekbulat F, Schmitt V, Hiebel C, Koziollek-Drechsler I, Clement AM, Moosmann B, Jung J, Behrends C, Dikic I, Kern A, Behl C.RAB3GAP1 and RAB3GAP2 modulate basal and rapamycin-induced autophagy. Autophagy. 2014; 10(12):2297-309. doi: 10.4161/15548627.2014.994359.
http://www.tandfonline.com/doi/full/10.4161/15548627.2014.994359#tabModule
Kontakt
Univ.-Prof. Dr. rer. nat. Christian Behl
Direktor des Instituts für Pathobiochemie
Universitätsmedizin der Johannes Gutenberg-Universität Mainz
Duesbergweg 6, 55099 Mainz, Telefon 06131 39 25890, Fax 06131 39 25792
E-Mail: cbehl@uni-mainz.de
http://www.unimedizin-mainz.de/pathobiochemie
Dr. Christine Ziegler
Institut für Pathobiochemie
Universitätsmedizin der Johannes Gutenberg-Universität Mainz
Telefon 06131 39 24552, E-Mail: christine.ziegler@uni-mainz.de
Pressekontakt
Oliver Kreft, Stabsstelle Kommunikation und Presse Universitätsmedizin Mainz,
Telefon 06131 17-7424, Fax 06131 17-3496, E-Mail: pr@unimedizin-mainz.de
Über die Universitätsmedizin der Johannes Gutenberg-Universität Mainz
Die Universitätsmedizin der Johannes Gutenberg-Universität Mainz ist die einzige medizinische Einrichtung der Supramaximalversorgung in Rheinland-Pfalz und ein international anerkannter Wissenschaftsstandort. Sie umfasst mehr als 60 Kliniken, Institute und Abteilungen, die fächerübergreifend zusammenarbeiten. Hochspezialisierte Patientenversorgung, Forschung und Lehre bilden in der Universitätsmedizin Mainz eine untrennbare Einheit. Rund 3.300 Studierende der Medizin und Zahnmedizin werden in Mainz ausgebildet. Mit rund 7.500 Mitarbeiterinnen und Mitarbeitern ist die Universitätsmedizin zudem einer der größten Arbeitgeber der Region und ein wichtiger Wachstums- und Innovationsmotor.
Weitere Informationen im Internet unter www.unimedizin-mainz.de
Media Contact
Alle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…
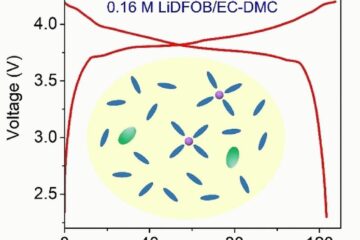
Für kostengünstigere, nachhaltigere Akkus
Ultraniedrig konzentrierter Elektrolyt für Lithium-Ionen-Batterien Lithium-Salze machen Akkumulatoren leistungsfähig, aber teuer. Ein ultraniedrig konzentrierter Elektrolyt auf Basis des Lithium-Salzes LiDFOB könnte eine kostengünstige und dabei nachhaltigere Alternative sein. Zellen mit…