Yin und Yang im Leben von Proteinen: Gegensätzliche Mechanismen beim Proteintransport in Peroxisomen
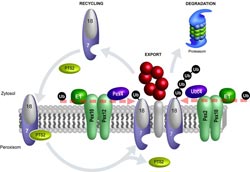
Modell des peroxisomalen Proteintransports: Der Import-Rezeptor für peroxisomale PTS2-Proteine (PTS2) ist der zweiteilige Rezeptor-Komplex Pex18/Pex7. Nachdem das PTS2-Protein ins Innere des Peroxisoms entlassen ist, wird der Rezeptor exportiert. Die Anheftung eines Ubiquitins (Ub) an Pex18 signalisiert, dass der Rezeptor für neue Import-Reaktionen recycelt werden kann. Verantwortlich für das Anheften des einzelnen Ubiquitins sind das E1-Enzym, das E2-Enzym Pex4p sowie die E3-Enzyme Pex12/Pex10. Bildet sich eine Ubiquitin-Kette an Pex18, baut das Proteasom Pex18 ab. Das Anheften der Ubiquitin-Kette erfolgt durch das E1-Enzym, das E2-Enzym Ubc4 sowie die E3-Enzyme Pex2/Pex10.<br><br>Copyright: RUB, Grafik: Platta<br>
Recycling oder „Schrottpresse“: Welche molekularen Maschinen über das Schicksal des Import-Rezeptors Pex18 entscheiden, haben Mediziner der Ruhr-Universität Bochum (RUB) herausgefunden. Pex18 ist für den Import von Proteinen in spezielle Zellbestandteile, die Peroxisomen, verantwortlich.
Zwei gegensätzlich wirkende Regulationskreise bestimmen, ob der Rezeptor nach erfolgtem Transport weiter arbeitet oder abgebaut wird. „Damit vervollständigt sich das Bild der Regulation des Proteinimports in Peroxisomen und wird zu einem einheitlichen Modell zusammengeführt“, sagt Juniorprofessor Dr. Harald Platta von der Medizinischen Fakultät der RUB. Gemeinsam mit Prof. Dr. Ralf Erdmann und weiteren Kollegen berichtet er in der Zeitschrift „Traffic“.
Ubiquitin-Signale bestimmen über das Schicksal des Rezeptors
Peroxisomen haben keine eigene DNA, sodass sie alle für ihre Funktion erforderlichen Proteine importieren müssen. Für diesen Zweck besitzt die Zelle dynamische Import-Rezeptoren, wie Pex18. Sie binden Proteine in der Zellflüssigkeit und bringen sie zum Peroxisom. In einer vorangegangen Arbeit zeigte das RUB-Team, dass das Signal-Protein Ubiquitin anschließend über das weitere Schicksal der Rezeptoren entscheidet:
Heftet sich ein einzelnes Ubiquitin-Molekül an den Rezeptor, wird dieser recycelt; er wandert zurück in die Zellflüssigkeit und beginnt einen neuen Transportvorgang. Heftet sich eine Ubiquitin-Kette an den Rezeptor, gibt das das Signal für den Abbau des Rezeptors durch das Proteasom, einer Art „intrazellulärer Schrottpresse“. Wie die Zelle auf molekularer Ebene bestimmt, was mit dem Rezeptor passiert, war bislang unbekannt.
Recycling oder „Schrottpresse“: Auf die Enzym-Kaskade kommt es an
Die RUB-Mediziner fanden heraus, dass unterschiedliche Enzym-Kaskaden
die beiden Ubiquitin-Modifikationen von Pex18 katalysieren. In beiden Fällen handelt es sich um einen Dreischrittprozess: Das E1-Enzym aktiviert das Ubiquitin-Signal, welches dann durch das E2-Enzym übertragen und letztlich durch die Koordination des E3-Enzyms an den Rezeptor angeheftet wird. Durch Analysen an Hefezellen fanden die Bochumer Mediziner heraus, dass E2- und E3-Enzyme in verschiedenen Varianten vorkommen, während es nur ein E1-Enzym gibt.
Für das Anheften eines einzelnen Ubiquitins und einer Ubiquitin-Kette sind unterschiedliche Kombinationen von E2- und E3-Enzymen verantwortlich. „Zwei entgegengesetzt wirkende molekulare Maschinen bestimmen also das Schicksal des Import-Rezeptors Pex18“, sagt Harald Platta. „Diese Entdeckung verdeutlicht, wie genau abgestimmt die Kontrolle des Rezeptors ist und wie genau die damit verbundene Regulation der gesamten peroxisomalen Funktion erfolgt. Diese Arbeiten werden eine wichtige Grundlage für die weitere Forschung an den molekularen Ursachen von peroxisomalen Erkrankungen sein.“
Peroxisomen: Multifunktionswerkzeuge der Zelle
Peroxisomen sind wichtige Reaktionsräume innerhalb der Zelle. Sie können über 50 verschiedene Enzyme enthalten, die entscheidend für den Abbau von Fettsäuren sind, die Entsorgung von Wasserstoffperoxid oder die Bildung von Plasmalogenen, die ein wichtiger Bestandteil der Weißen Substanz des Gehirns sind. Ist der Proteinimport in Peroxisomen gestört, wirkt sich das negativ auf den gesamten Stoffwechsel aus und kann vor allem für Neugeborene tödlich sein.
Titelaufnahme
F. El Magraoui, R. Brinkmeier, A. Schrötter, W. Girzalsky, T. Müller, K. Marcus, H.E. Meyer, R. Erdmann, H.W. Platta (2013): Distinct ubiquitination cascades act on the PTS2-co-receptor Pex18p, Traffic, DOI: 10.1111/tra.12120
Weitere Informationen
Jun.-Prof. Dr. Harald W. Platta, Physiologische Chemie, Medizinische Fakultät der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24968, E-Mail: Harald.Platta@rub.de
Angeklickt
Frühere Presseinfo zum Proteinimport in Peroxisomen
http://aktuell.ruhr-uni-bochum.de/pm2011/pm00233.html.de
Redaktion: Dr. Julia Weiler
Media Contact
Weitere Informationen:
http://www.ruhr-uni-bochum.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















