Winziger Unterschied macht Alzheimer-Protein noch schädlicher
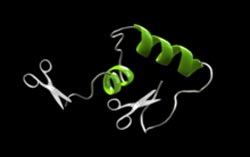
Das Amyloid-beta Protein wird aus einem größeren Proteinmolekül von zwei molekularen Scheren herausgeschnitten. Die Scheren setzen nicht immer genau an derselben Stelle an. Bei pyroGlu-Abeta werden am sogenannten "N-terminus" (links) zwei Aminosäuren mehr abgeschnitten. Copyright: TRICKLABOR
Im Gehirn entstehende Verklumpungen des körpereigenen Proteins Amyloid-beta (Aβ) gelten als Ursache der Alzheimerschen Demenz. Weniger bekannt ist bisher eine besonders aggressive Variante des Proteins: „Pyroglutamat- Aβ“, das in extrem hohem Tempo verklumpt, resistenter gegen Abbauprozesse ist und auf Gehirnzellen noch giftiger wirkt.
Wissenschaftler des Forschungszentrums Jülich konnten nun mit hochauflösenden Methoden erstmals Einblicke darin gewinnen, auf welche Weise sich feine Unterschiede in der Struktur dieses Moleküls auswirken und die Verklumpung beeinflussen. Die Ergebnisse wurden in der aktuellen Ausgabe der Fachzeitschrift Biophysical Journal veröffentlicht.
Aβ-Proteine entstehen bei jedem Menschen das ganze Leben lang und sind als Einzelmoleküle harmlos. Lagern sie sich jedoch zusammen, können sie schädliche Aggregate bilden. Die Mehrheit der Therapieansätze gegen Alzheimer richtet sich deshalb gegen dieses Protein. Allerdings gibt es im Körper nicht nur eine Aβ-Form, sondern eine ganze Gruppe leicht unterschiedlicher Varianten. Eine davon, das sogenannte Pyroglutamat-Aβ, steht besonders in Verdacht, eine Schlüsselrolle für die Initiierung der Krankheit zu spielen.
Pyroglutamat-Aβ fehlen zwei Aminosäuren an einem Ende des Moleküls, eine dritte ist von einem Glutamat zu einem Pyroglutamat umgewandelt. Eigentlich sind diese Änderungen bei einem Molekül aus circa 40 Aminosäuren eher geringfügig. Die biochemischen Eigenschaften wandeln sich dadurch jedoch dramatisch: die Pyroglutamat-Variante verklumpt mehr als hundertmal schneller zu schädlichen Aggregaten als die „ungekürzte“ Form Aβ(1-42).
„Das weist auf eine Schlüsselrolle im Krankheitsgeschehen hin und macht diese Proteinform zu einem wichtigen Ziel für Wirkstoffe“, sagt Prof. Dieter Willbold, Direktor am Jülicher Institute of Complex Systems. „Auch für unseren eigenen in Jülich entwickelten Wirkstoffkandidaten, der unter anderem an diese Aβ-Variante bindet.“
In den Alzheimer-typischen Amyloid-Plaques im Gehirn findet sich zudem die Pyroglutamat-Variante als überproportional häufiger Bestandteil: Sie macht etwa 20 Prozent allen Aβ-Proteins im Gehirn aus, aber bis zu 50 Prozent des Proteins in den Ablagerungen.
Was aber auf molekularer Ebene anders läuft, wenn Pyroglutamat-Aβ verklumpt, ist bis jetzt nahezu unbekannt. Gerade das hohe Tempo der Aggregatbildung erschwert dabei die Untersuchung. Denn für die wenigen geeigneten Verfahren müsste ein Zustand einige Zeit stabil bleiben, um ihn überhaupt analysieren zu können.
Das Jülicher Team um Erstautorin Dr. Christina Dammers etablierte nun erstmals eine Vorgehensweise, mit der das Protein und seine rapide beschleunigte Aggregation mit dem hochauflösenden Verfahren der NMR-Spektroskopie analysiert werden kann.
Wie sie zeigen konnten, hat die Änderung der drei Aminosäuren unerwartet weitreichende Auswirkungen auf das Molekül. Die Orientierungen der nächstliegenden zehn Aminosäuren zueinander sind ebenfalls verändert, sodass insgesamt etwa ein Drittel des Proteins betroffen ist. Auch in den frühen Stadien der Aggregation offenbarte sich ein Unterschied.
„Die Ablagerungen bestehen am Ende aus flachen, sogenannten beta-Faltblättern“, sagt Willbold. „Wir haben jetzt aber erstmals sehen können, dass sich diese bei Pyroglutamat-Aβ nicht sofort bilden, sondern ein Zwischenstadium mit sogenannten helikalen Strukturen entsteht.“
Diese Proteinstrukturformen, die einer aufgeringelten Telefonschnur ähneln, treten bei den anderen Aβ-Formen nicht auf. Den Ansatz könnte man für weitere Experimente nutzen, um genauere Informationen für ein tieferes Verständnis der unterschiedlichen Proteinformen und gezielte therapeutische Ansätze zu gewinnen.
Originalpublikation: Christina Dammers, Kerstin Reiss, Lothar Gremer, Justin Lecher, Tamar Ziehm, Matthias Stoldt, Melanie Schwarten, Dieter Willbold: Pyroglutamate-Modified Amyloid-β(3–42) Shows α-Helical Intermediates before Amyloid Formation. Biophysical Journal, Volume 112, Issue 8, 25 April 2017, Pages 1621–1633.
DOI: 10.1016/j.bpj.2017.03.007
Weitere Informationen:
Institut of Complex Systems, Strukturbiochemie (ICS-6)
Ansprechpartner:
Dr. Melanie Schwarten
Institute of Complex Systems, Strukturbiochemie (ICS-6), Forschungszentrum Jülich
D-52425 Jülich, Germany
Tel.: +49-2461-61-6940
E-Mail: m.schwarten@fz-juelich.de
Prof. Dieter Willbold
Institute of Complex Systems, Strukturbiochemie (ICS-6), Forschungszentrum Jülich
Institut für Physikalische Biologie der Heinrich-Heine-Universität Düsseldorf
Tel.: +49 2461 61-2100
E-Mail: d.willbold@fz-juelich.de
Pressekontakt:
Peter Zekert
Tel: +49 2461 61-9711
E-Mail: p.zekert@fz-juelich.de
Media Contact
Weitere Informationen:
http://fz-juelich.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















