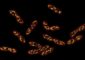
Stau in der Zelle

Quelle: Lena Reimann, Arbeitsgruppe Warscheid
Ein Team um Prof. Dr. Bettina Warscheid von der Universität Freiburg und Prof. Dr. Agnieszka Chacinska vom Internationalen Institut für Molekular- und Zellbiologie in Warschau/Polen hat den Mechanismus „Unfolded Protein Response activated by mistargeting of proteins“, kurz UPRam, entdeckt:
Dieser schützt Zellen davor, dass sich in ihrem Inneren zu viele mitochondriale Vorläuferproteine anstauen, die ihr Ziel – das Mitochondrium – wegen eines Defekts im Proteinimportsystem verfehlt haben. Die Studie zeigt, wie die Zelle auf Stress reagiert, der durch Proteinanstau ausgelöst wird, um sich ihr Überleben zu sichern.
Die Daten können helfen, die Mechanismen alterungsbedingter und neurodegenerativer Erkrankungen zukünftig besser zu verstehen. Diese gehen häufig mit einer mitochondrialen Dysfunktion und Störungen bei der Erhaltung des Gleichgewichtszustandes der Zelle einher. Die Forschungsergebnisse sind nun in der Fachzeitschrift „Nature“ erschienen.
Mitochondrien, allgemein als „Kraftwerke der Zelle“ bekannt, benötigen mehr als tausend Proteine, um ihre vielfältigen Funktionen erfüllen zu können. Die Mehrzahl der mitochondrialen Proteine wird im Zytosol, der Zellflüssigkeit, hergestellt und muss anschließend in die Mitochondrien transportiert werden. Ist dieser Proteinimport gestört, kommt es zu Fehlfunktionen der Mitochondrien sowie zur Ansammlung mitochondrialer Vorläuferproteine im Zytosol.
Wie die Zelle auf den daraus resultierenden Stress reagiert, war bislang nicht bekannt. Um diese Frage beantworten zu können, haben Dr. Silke Oeljeklaus und Dr. Sebastian Wiese aus Warscheids Forschungsteam mithilfe der hochauflösenden Massenspektrometrie untersucht, wie das Proteom der Zellen mit einem gestörten mitochondrialen Proteinimport verändert ist.
Das Proteom einer Zelle umfasst alle Proteine, die in dieser zu einem bestimmten Zeitpunkt vorhanden sind. Auf Grundlage dieser Daten entdeckte das Forschungsteam, dass der Mechanismus UPRam zwei Hauptwege beinhaltet, mit denen sich die Zelle bei fehlerhaftem mitochondrialen Proteinimport schützt: Erstens hemmt sie die Translation, das heißt die Herstellung der Proteine im Zytosol, um einer weiteren Ansammlung mitochondrialer Vorläuferproteine entgegenzuwirken. Zweitens aktiviert die Zelle das Proteasom, eine Proteinabbaumaschine, die den bereits vorhandenen Proteinanstau behebt.
Um UPRam nachzuweisen, haben die Wissenschaftlerinnen und Wissenschaftler die Aktivierung des Proteasoms durch künstlich fehlgeleitete mitochondriale Proteine von der Hemmung der Translation entkoppelt. Sie zeigten so, dass die Zelle ihr inneres Gleichgewicht aufrechterhält, weil sie den Status der Mitochondrien und Mechanismen für die Regulation der zellulären Proteinhomöostase aufeinander abstimmt. Die Zelle aktiviert das Proteasom, indem sie dieses effizienter zusammenbaut, und reagiert somit direkt auf die Menge der Proteine, die nicht in Mitochondrien importiert werden konnten.
Bettina Warscheid ist Leiterin der Abteilung Biochemie – Funktionelle Proteomforschung, Institut für Biologie II, und Mitglied des Exzellenzclusters BIOSS Centre for Biological Signalling Studies. Silke Oeljeklaus ist Akademische Oberrätin in der Abteilung Biochemie – Funktionelle Proteomforschung. Sebastian Wiese war wissenschaftlicher Mitarbeiter in Warscheids Arbeitsgruppe und leitet nun die Zentrale Einheit „Massenspektrometrie und Proteomik“ an der Medizinischen Fakultät der Universität Ulm.
Originalpublikation:
Lidia Wrobel*, Ulrike Topf*, Piotr Bragoszewski, Sebastian Wiese, Malgorzata E. Sztolsztener, Silke Oeljeklaus, Aksana Varabyova, Maciej Lirski, Piotr Chroscicki, Seweryn Mroczek, Elzbieta Januszewicz, Andrzej Dziembowski, Marta Koblowska, Bettina Warscheid# & Agnieszka Chacinska#. Mistargeted mitochondrial proteins activate a proteostatic response in the cytosol. (2015). Nature. doi:10.1038/nature14951. (*#Diese Autorinnen sind zu gleichen Teilen beteiligt.)
Kontakt:
Prof. Dr. Bettina Warscheid
Institut für Biologie II
Albert-Ludwigs-Universität Freiburg
Tel.: 0761/203-2690
E-Mail: bettina.warscheid@biologie.uni-freiburg.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Wie die Galvanotechnik durch Digitalisierung effizient wird
SurfaceTechnology GERMANY… Digitalisierung und Hartverchromung aus Chrom(III)-Elektrolyten: Das sind die beiden großen Themen, mit denen sich Forscherinnen und Forscher von der Abteilung Galvanotechnik am Fraunhofer IPA derzeit beschäftigen. Ihre Erkenntnisse…

Ersatz für Tierversuche – jetzt ganz ohne Tierleid
Erstes Gewebe-Modell der Leber völlig ohne Materialien tierischer Herkunft hergestellt. Wissenschaftler*innen der TU Berlin haben mit Hilfe von 3D-Biodruck erstmals ein Modell der Leber aus menschlichen Zellen hergestellt, ohne dabei…
Neue Wege zur mentalen Gesundheit
Magnetspule am Kopf sorgt für antidepressive Effekte… In der Klinik und Poliklinik für Psychiatrie und Psychotherapie am Universitätsklinikum Bonn (UKB) wird derzeit eine Studie zur Erforschung der antidepressiven Wirkung einer…