Seltene Proteine kollabieren früher
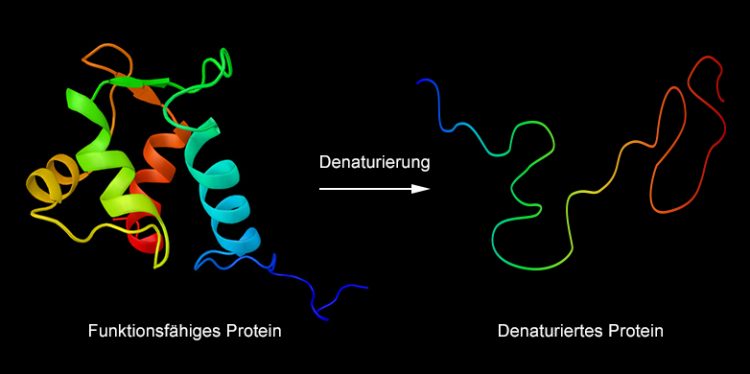
Bei hohen Temperaturen denaturieren Proteine. Sie verlieren dabei ihre Form. Grafik: Fotolia / ibreakstock
Man schlägt ein Ei auf, lässt es in die heisse Bratpfanne gleiten – und fast unmittelbar danach wird das transparente und glibbrige Eiklar weiss und fest. Was man beim Spiegeleierbraten beiläufig beobachtet, ist ein wichtiges biochemisches Phänomen: die Denaturierung von Proteinen.
Proteine werden in der Zelle als fadenförmige Moleküle hergestellt, die anschliessend zu einer proteinspezifischen Form zusammengeknäuelt werden: Manche sind kugelig, andere röhrenförmig. Bei der Denaturierung zerfallen diese Formen. Die Proteine werden wieder fädig und büssen dadurch auch ihre Funktionen ein.
Denaturierung auf einen Schlag?
Bislang ging die Forschung aufgrund von Computeranalysen davon aus, dass ein Grossteil der Proteine einer Zelle denaturieren, wenn der schmale Temperaturbereich, in welchem Proteine optimal funktionieren, überschritten wird. Beim Darmbakterium E. coli liegt die optimale Betriebstemperatur bei rund 37 Grad Celsius, ab 46 Grad sterben die Bakterien ab, weil die Formen ihrer Proteine zerfallen.
Diese grundsätzliche Annahme stösst nun ein Team von Forschenden unter der Leitung von Paola Picotti, Assistenzprofessorin in Biochemie der ETH Zürich, um. In einer Studie, die soeben in der Fachzeitschrift «Science» erschien, zeigen die Forscherinnen und Forscher auf, dass beim Erreichen eines kritischen Temperatur-Schwellenwerts nur ein kleiner Anteil von Schlüsselproteinen gleichzeitig denaturieren.
In ihrer Studie – der umfassendsten, die je zu diesem Thema gemacht wurde – untersuchten und verglichen sie die Gesamtheit aller Proteine, das sogenannte Proteom, von vier Organismen bei unterschiedlichen Temperaturen.
So setzten die Forschenden das Darmbakterium E. coli, menschliche Zellen, Hefezellen und das hitzebeständige Bakterium T. thermophilus schrittweise steigenden Temperaturen bis zu 76 Grad aus. Nach jedem Temperaturschritt massen die Wissenschaftlerinnen sämtliche in den Zellen vorhandenen Proteine und bestimmten deren Struktur. Total analysierten die Forschenden 8000 verschiedene Proteine.
Schlüsselkomponenten zerfallen zuerst
«Dank diesen Untersuchungen können wir nun aufzeigen, dass bei Temperaturen, bei denen die Organismen jeweils absterben, nur wenige Proteine kollabieren», sagt Picotti. «Die Voraussage, dass die Mehrzahl der Proteine eines Organismus gleichzeitig denaturieren, konnten wir nicht bestätigen.»
Rund 80 der untersuchten Proteine zerfielen bereits dann, wenn die Temperatur das artspezifische Optimum um wenige Grad überstiegen hatte. Obschon sie nur einen kleinen Teil der Proteine einer Zelle ausmachen, ist das für die Zelle fatal, denn manche dieser Proteintypen üben lebenswichtige Funktionen aus oder sind zentrale Schlüsselkomponenten in einem grossen Proteinnetzwerk. «Sobald diese Schlüsselkomponenten ausfallen, kann die Zelle nicht weiterleben», sagt Picotti.
Flexibilität kann instabil machen
Dass Schlüsselkomponenten eines biologischen Systems hitzeempfindlich sind, erscheint auf den ersten Bilck als Fehlleistung der Evolution. Diese Proteine seien aber instabil als Folge ihrer Flexibilität, um vielfältige Aufgaben in der Zelle erledigen zu können, sagt die Biochemikerin. «Flexibilität und Stabilität können sich gegenseitig ausschliessen. Die Zelle muss da einen Kompromiss eingehen.»
Die Forschenden zeigen zudem auf, dass die Proteine, die am stabilsten und am wenigsten anfällig für Verklumpungen oder anomale Faltungen sind, in den Zellen auch die häufigsten sind. Aus Sicht der Zelle sei dies sinnvoll. Wäre es umgekehrt und würden die häufigsten Proteine am schnellsten anormale Strukturen annehmen, müsste die Zelle viel Energie in deren Wiederaufbau oder deren Entsorgung investieren. Deshalb sorgen Zellen dafür, dass häufige Proteine stabiler sind als die seltenen.
Weshalb aber können dem Bakterium T. thermophilus selbst Temperaturen von über 70 Grad nichts anhaben? Diese Zellen, so die Forscherin, würden bevorzugt die hitzesensibleren und für die Funktion unentbehrlichen Proteine stabilisieren, unter anderem durch angepasste Proteinsequenzen.
Wärmetolerante Bakterien für industrielle Prozesse
Picottis Erkenntnisse könne dabei helfen, Organismen genetisch so zu verändern, dass sie höhere Temperaturen ertragen. Bereits heute werden gewisse Chemikalien, wie zum Beispiel Ethanol, biotechnologisch mit Hilfe von Bakterien produziert. Oft arbeiten diese Bakterien nur in einem engen Temperaturfenster, was jedoch beim Ertrag Grenzen setzt. Könnte die Produktion bei höheren Temperaturen ablaufen, könnte der Ertrag optimiert werden, ohne dass die Bakterien Schaden nehmen.
Die Forscher fanden auch Anzeichen dafür, dass gewisse denaturierte Proteine bei noch höheren Temperaturen dazu tendieren, sich erneut zu verklumpen und Aggregate zu bilden. In menschlichen Zellen fanden Picotti und Kollegen das Protein DNMT1, das bei zunehmender Wärme erst denaturiert und später mit Seinesgleichen aggregiert. Dieses und weitere Proteine mit ähnlichen Eigenschaften wird mit Nervenerkrankungen wie Alzheimer oder Parkinson in Verbindung gebracht.
Erste umfassende Stabilitätsstudie
Bei dieser Studie handelt sich um die erste, welche die Hitzestabilität von Proteinen mehrerer Organismen und in grossem Massstab direkt in der komplexen Zellmatrix untersuchte. Proteine wurden für die Messungen weder aus dem Zellsaft isoliert noch gereinigt. Die Forscher brachen für ihre Untersuchungen die Zellen auf und massen danach bei verschiedenen Temperaturen die Stabilität aller Proteine direkt im Zellsaft.
Literaturhinweis
Leuenberger P, Ganscha S, Kahraman A, Cappelletti V, Boersema PJ, von Mering C, Claassen M, Picotti P. Cell-wide analysis of protein thermal unfolding reveals determinants of thermostability. Science 2017. 355: eaal7825, doi: 10.1126/science.aal7825
https://www.ethz.ch/de/news-und-veranstaltungen/eth-news/news/2017/02/seltene-pr…
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge
Forschende enthüllen neue Funktion von Onkoproteinen
Forschende der Uni Würzburg haben herausgefunden: Das Onkoprotein MYCN lässt Krebszellen nicht nur stärker wachsen, sondern macht sie auch resistenter gegen Medikamente. Für die Entwicklung neuer Therapien ist das ein…

Mit Kleinsatelliten den Asteroiden Apophis erforschen
In fünf Jahren fliegt ein größerer Asteroid sehr nah an der Erde vorbei – eine einmalige Chance, ihn zu erforschen. An der Uni Würzburg werden Konzepte für eine nationale Kleinsatellitenmission…

Zellskelett-Gene regulieren Vernetzung im Säugerhirn
Marburger Forschungsteam beleuchtet, wie Nervenzellen Netzwerke bilden. Ein Molekülpaar zu trennen, hat Auswirkungen auf das Networking im Hirn: So lässt sich zusammenfassen, was eine Marburger Forschungsgruppe jetzt über die Vernetzung…