Proteinen bei der Arbeit zugesehen: Calmodulin, ein Protein packt zu

Mit einem speziellen Kraft-Mikroskop können Forscher der TU München direkt die mechanischen Veränderungen eines einzelnen Calmodulin-Moleküls bei der Anlagerung an andere Eiweiße messen. Die für das Verständnis der Arbeit des Calmodulins wichtigen Forschungsergebnisse werden in der aktuellen Ausgabe des Magazins Science veröffentlicht (Science, 30. Januar 2009: Vol. 323. no. 5914, p. 593).
Seit langem gilt das Eiweiß Calmodulin als eines der wichtigsten Signalmoleküle. Indem es sich anlagert oder wieder ablöst gibt es Start- und Stop-Signale für eine große Zahl von Proteinaktivitäten. Calmodulin kann bis zu vier Calcium-Ionen binden. Der Körper nutzt dies, um die Aktivität des Calmodulins zu kontrollieren. Je nach dem, wie viele Calcium-Ionen an das Calmodulin gebunden sind, nimmt es eine unterschiedliche räumliche Struktur ein. Und je nach seiner Struktur kann es sich an unterschiedliche Aminosäureketten von Proteinen anlagern.
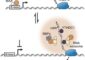
Die Garchinger Forscher haben es nun geschafft, ein einzelnes Calmodulin-Molekül auf der einen Seite auf einer Platte zu fixieren und auf der anderen Seite an die Spitze eines Kraft-Mikroskops anzuhängen. Mit dieser Anordnung können Sie nun dem Molekül bei der Arbeit zuschauen. Geben die Wissenschaftler Calcium-Ionen in die Lösung, so dehnt sich das Calmodulin aus und bindet vier Calcium-Ionen. Es hat nun völlig andere mechanische Eigenschaften, die die Forscher mit ihrem Mikroskop gut verfolgen können. Auch die Bindung an Aminosäureketten testeten die Forscher bereits und konnten damit zeigen, wie das Calmodulin bestimmte Ketten erkennt und sich an diese anlagert.
„Das Besondere an unserer Technologie ist, dass wir direkt in wässriger Lösung arbeiten können,“ sagt Professor Matthias Rief, der die Arbeitsgruppe leitet. „Wir können genau unter den Bedingungen messen, unter denen das Protein auch in seiner natürlichen Umgebung arbeitet.“ Die Methode ist damit eine wertvolle Ergänzung der Röntgenstrukturanalyse, die zwar die genaue räumliche Struktur eines Proteins zeigt, aber dafür geordnete Kristalle braucht. Von dynamischen Vorgängen kann Röntgenstrukturanalyse allenfalls Momentaufnahmen liefern. „Wir können nun direkt beobachten, wie das Calmodulin sich die Aminosäurekette schnappt und sich umfaltet, um diese festzuhalten.“
Mit ihrem Kraft-Mikroskop können die Wissenschaftler um Matthias Rief direkt die Kräfte messen, die man benötigt, um das Calmodulin aus der jeweils stabilen Lage heraus umzufalten. Daraus können sie die Energien berechnen, die bei der Anlagerung von Calcium und Aminosäureketten an das Calmodulin auftreten. Und indem sie die mechanischen Eigenschaften über eine gewisse Zeit verfolgen, können sie auch feststellen, wie lange ein anderes Proteinfragment gebunden bleibt.
„Wir haben mit der Entwicklung dieser Methode ein Fenster aufgestoßen, durch das wir sehr viel über die grundsätzlichen Abläufe in der Zelle erfahren können,“ sagt Rief. „Es ist unglaublich faszinierend, direkt die dynamischen Abläufe ansehen zu können. Das Calmodulin wird nicht das einzige Molekül bleiben, das wir uns genauer ansehen.“
Originalbeitrag
Jan Philipp Junker, Fabian Ziegler, Matthias Rief
Ligand-Dependent Equilibrium Fluctuations of Single Calmodulin Molecules
Science, 30 January 2009: Vol. 323. no. 5914, pp. 593 – 594 – DOI: 10.1126/science.1169555
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…