Neue Wirkmechanismen eröffnen alternative Wege zur Entwicklung von Antibiotika
Das Ziel des Angriffs: die Protease ClpP<br>Bild: M. Gersch/F. Alte / TUM <br>
Sie spalten andere Eiweiße und bewirken, dass diese korrekt auf- oder abgebaut werden. Auch für die krankheitserregende Wirkung vieler Bakterienarten sind Proteasen verantwortlich.
Nun haben Chemiker der Technischen Universität München (TUM) zwei bislang unbekannte Wirkmechanismen entdeckt, mit denen eine wesentliche bakterielle Protease dauerhaft ausgeschaltet werden kann.
Proteine bestehen aus einer Kette von Aminosäuren und sind für sämtliche Prozesse in der Zelle wesentlich. Einer der wichtigsten Proteintypen sind die Proteasen. Wie kleine „molekulare Scheren“ schneiden sie andere Eiweiße an bestimmten Stellen und übernehmen auf diese Weise wichtige Funktionen in der Zelle. Durch die Spaltung werden andere Proteine beispielsweise an- oder ausgeschaltet, fehlerhafte Proteine abgebaut oder Signalsequenzen, die dazu dienen Proteine an die richtige Stelle der Zelle zu transportieren, entfernt.
Doch nicht nur für menschliche Zellen sind Proteasen wichtig – auch Bakterien sind auf sie angewiesen. Gegen manche krankheitserregende Arten, wie etwa einige multiresistente Stämme des Erregers Staphylococcus aureus und des Tuberkulose verursachenden Bakteriums Mycobacterium tuberculosis gibt es heute kaum noch wirksame Antibiotika.
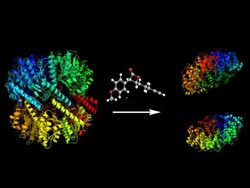
Mit hohem Aufwand versuchen Forscher daher weltweit neue Wege zu finden, die in diesen Stämmen vorkommenden Proteasen auszuschalten und so die Erreger zu bekämpfen. Im Zentrum der Bemühungen steht die sogenannte ClpP-Protease. Sie besteht aus vierzehn Untereinheiten und hat eine zentrale regulatorische Funktion. Meist wird versucht sie durch Substanzen auszuschalten, die alle aktiven Zentren der ClpP blockieren. Dies sind quasi „die Klingen der Schere“, jene Stellen des Proteins also, die für die Spaltung verantwortlich sind.
„Bisher eingesetzte Hemmstoffe haben jedoch einen entscheidenden Nachteil“, erklärt Stephan Sieber, Inhaber des Lehrstuhls für organische Chemie II der Technischen Universität München (TUM). „Sie schalten das Protein nicht dauerhaft aus, sondern wirken nur für einige Stunden. Zudem müssen sie alle aktiven Zentren des Proteins angreifen um eine Wirkung zu erzielen.“
Im Rahmen einer Kooperation mit Prof. Michael Groll, Inhaber des Lehrstuhls für Biochemie, ist es Malte Gersch und Roman Kolb, Doktoranden am Lehrstuhl von Professor Sieber, gelungen, gleich zwei vollkommen neue Mechanismen aufzuklären, mit denen diese wichtige bakterielle Protease dauerhaft ausgeschaltet werden kann – und das in einem Fall sogar ohne alle aktiven Zentren des Proteins angreifen zu müssen.
Der erste Mechanismus stört die Anordnung von Aminosäuren, die für den Zusammenhalt der Protease notwendig sind. Das lässt sie in zwei Teile zerfallen. Der zweite setzt direkt am Kern des aktiven Zentrums an. Er wandelt die Aminosäure, die die eigentliche Spaltung durchführt, in eine andere um – die „Schere“ wird stumpf, das Protein funktionsunfähig. Beide Wege hemmen die Protease auf vollkommen neue Weise und liefern daher vielversprechende Ansätze zur Entwicklung neuer Medikamente.
Die Wissenschaftler fanden zudem eine ganze Reihe von Hemmstoffen, die die beiden Mechanismen auslösen. „Es ist ein großer Fortschritt, dass wir nun wissen, auf welchen Wegen Substanzen die Protease ausschalten“, sagt Gersch. „Wir können nun die Substanzen optimieren und das Prinzip vielleicht auch auf andere Proteasen übertragen.“
In weiteren Forschungen möchten Gersch und Sieber ihre Substanzen an lebenden Bakterienstämmen testen, um zu sehen, ob diese in ihrem Wachstum und ihrer Pathogenität tatsächlich gehemmt werden. „Die Bakterien werden nach unseren jetzigen Erkenntnissen zwar nicht komplett ausgeschaltet, doch sie produzieren wesentlich weniger Toxine, die für eine Entzündung förderlich sind“, meint Gersch. „Die Grundidee dahinter ist, dass die Bildung neuer Resistenzen unterdrückt wird und wir damit dem Immunsystem mehr Zeit geben, selbst mit dem Erreger fertig zu werden.“
Die Forschungsarbeiten wurden gefördert von der Deutschen Forschungsgemeinschaft (DFG) im Rahmen der Sonderforschungsbereiche SFB 749 und SFB 1035 sowie über den Exzellenzcluster Center for Integrated Protein Research Munich (CIPSM), aus Mitteln des European Research Council (ERC starting grant), des Fonds der Chemischen Industrie und der Studienstiftung des Deutschen Volkes. Die Kristallstrukturen wurden in Kooperation mit der Synchrotronquelle des Paul Scherrer Instituts in Villigen (Schweiz) ermittelt.
Originalpublikation:
Malte Gersch, Roman Kolb, Ferdinand Alte, Michael Groll, Stephan Sieber. Disruption of Oligomerization and Dehydroalanine Formation as Mechanisms for ClpP Protease Inhibition. Journal of the American Chemical Society (JACS), 2014, 136 (4), pp 1360-1366. DOI: 10.1021/ja4082793
Kontakt:
Prof. Dr. Stephan A. Sieber
Lehrstuhl für organische Chemie II
Technische Universität München
Lichtenbergstr. 4, 85747 Garching, Germany
+49 89 289 13302 / 13301 (Sekr.)
E-Mail: stephan.sieber@mytum.de
Weitere Informationen:
http://pubs.acs.org/doi/abs/10.1021/ja4082793
Media Contact
Weitere Informationen:
http://www.tum.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















