Neue Einblicke in die Evolution des Stoffwechsels
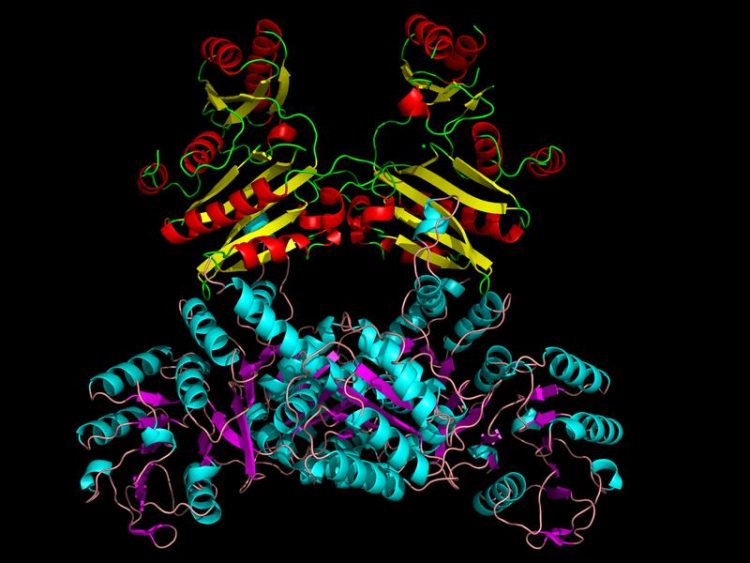
Dreidimensionale Architektur des in der Evolution frühzeitig entstandenen Enzyms der Energieumwandlung, isoliert aus einem hitzestabilen Urorganismus. Abbildung: Axel Scheidig
Dabei fanden sie den bislang unbekannten Mechanismus heraus, durch den die Umwandlung energiereicher Verbindungen, sogenannte Thioester, in Adenosintriphosphat (ATP, dem universellen Energieüberträger aller Lebewesen) ermöglicht wird.
Die Entdeckung des Katalysemechanismus erlaubt neue Einblicke in die evolutionäre Entwicklung des Stoffwechsels. Die Forschenden veröffentlichten ihre Ergebnisse kürzlich in der renommierten Fachzeitschrift Proceedings of the National Academy of Sciences of the United States of America (PNAS).
Beim Stoffwechsel machen Enzyme die Arbeit, so auch in Archaeen. Die sogenannten Acetyl-Coenzym A Synthetasen unter ihnen haben sich die Kieler Forscher genauer angeschaut. Denn sie ermöglichen die Übertragung eines Stoffwechselprodukts (aktiviertes Phosphat) zwischen zwei räumlich getrennten aktiven Zentren, um ATP zu bilden.
Seit Beginn der Charakterisierung dieser Enzyme war es ein Rätsel, wie der Übergang funktioniert. Wissenschaftlerinnen und Wissenschaftler gingen seit über zehn Jahren davon aus, dass das aktivierte Phosphat durch eine Art Schwingen vom einen zum anderen Zentrum gelangt. Diese These konnte aber bislang nicht nachgewiesen werden.
Mithilfe eines speziellen Verfahrens zur Darstellung der Kristallstruktur, der sogenannten Röntgendiffraktion, ist es den Kieler Forschungsteams erstmals gelungen, die dreidimensionale Architektur der Acetyl-Coenzym A Synthetase nachzuvollziehen. Mit Hilfe von neun unterschiedlichen Kristallen konnten sie Momentaufnahmen des Enzyms während der Katalyse aufnehmen und damit den sich umlagernden Proteinbereich sichtbar machen.
Mit dieser Methode konnten sie sehen, dass ein Proteinsegment im Enzym das aktivierte Phosphat (~P) überträgt. Die lang diskutierte Hypothese des Schleifen-Schwingens (‚loop swinging‘) zwischen den aktiven Zentren konnte damit bewiesen werden. „Die von uns entschlüsselten Strukturen liefern wichtige Erkenntnisse für den Katalysemechanismus dieser ungewöhnlichen Enzymklasse“, freuen sich Professor Schönheit und Professor Scheidig über die Entdeckung.
Ausgehend von ihrer Arbeit versuchen die Forschenden nun, die Enzyme, die auch in pathogenen Mikroorganismen vorkommen, weiter zu charakterisieren. Schönheit: „Unser Wunschziel ist es, dieses für den Energiehaushalt wesentliche Enzym gezielt ausschalten zu können und damit die krankheitserregenden Organismen im menschlichen Körper wirksam zu bekämpfen.“
Originalarbeit:
Weiße, R. H.-J., Faust, A., Schmidt, M. C., Schönheit, P., Scheidig, A. J. (2016). Structure of NDP forming acetyl-coenzyme A synthetase ACD1 reveals large rearrangement for phosphoryl-transfer. Proc. Natl. Acad. Sci. U.S.A. 113:519-528 DOI: 10.1073/pnas.1518614113
http://www.pnas.org/content/113/5/E519
Weitere Informationen über die Besonderheiten der Archaeen gibt es in der unizeit:
http://www.uni-kiel.de/unizeit/index.php?bid=340102&light=sch%F6nheit
Bildmaterial steht zum Download bereit:
http://www.uni-kiel.de/download/pm/2016/2016-420-1.jpg
Bildunterschrift: Dreidimensionale Architektur des in der Evolution frühzeitig entstandenen Enzyms der Energieumwandlung, isoliert aus einem hitzestabilen Urorganismus.
Abbildung: Axel Scheidig
http://www.uni-kiel.de/download/pm/2016/2016-420-2.jpg
Bildunterschrift: Peter Schönheit und Axel Scheidig erforschten die Umwandlung energiereicher Verbindung in Urbakterien. In den Händen halten die Wissenschaftler ein Modell des Acetyl-Coenzyms A.
Foto/Copyright: Raissa Nickel, Uni Kiel
http://www.uni-kiel.de/download/pm/2016/2016-420-3.jpg
Bildunterschrift: Die Art Pyrococcus furiosus gehört zu den ursprünglichsten Lebewesen.
Abbildung: Dr. Annett Bellack, Universität Regensburg
http://www.uni-kiel.de/download/pm/2016/2016-420-4.jpg
Bildunterschrift: Die Struktur Acetyl-Coenzym A Synthetase zeigt einen ursprünglichen Energiewandler in der frühen Evolution des Stoffwechsels.
Abbildung: Axel Scheidig
Kontakt:
Prof. Dr. Peter Schönheit
Institut für Allgemeine Mikrobiologie, CAU
Telefon: 0431 880-4328
E-Mail: peter.schoenheit@ifam.uni-kiel.de
Prof. Dr. Axel Scheidig
Zentrum für Biochemie und Molekularbiologie an der CAU
Telefon: 0431/880-4286
E-Mail: axel.scheidig@strubio.uni-kiel.de
Christian-Albrechts-Universität zu Kiel
Presse, Kommunikation und Marketing, Dr. Boris Pawlowski, Redaktion: Raissa Nickel
Postanschrift: D-24098 Kiel, Telefon: (0431) 880-2104, Telefax: (0431) 880-1355
E-Mail: presse@uv.uni-kiel.de, Internet: http://www.uni-kiel.de, Twitter: http://www.twitter.com/kieluni Facebook: http://www.facebook.com/kieluni, Instagram: http://www.instagram.com/kieluni
http://www.uni-kiel.de/pressemeldungen/index.php?pmid=2016-420-energiewandler Link zur Pressemeldung
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















