Molekulare Leibwächter für unreife Membranproteine
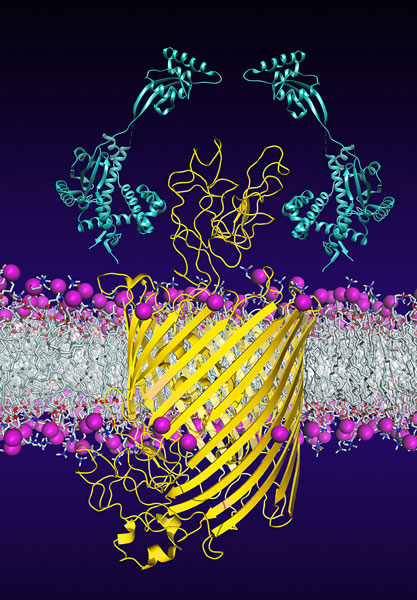
Chaperone (hellblau) helfen beim Einbau und der Faltung des bakteriellen Membranproteins FhuA (gelb). Universität Basel, Biozentrum
Ununterbrochen produzieren Maschinen in der Zelle lange Peptidketten, die Proteine. Damit ein Protein seine Aufgaben ordentlich erfüllen kann, muss es dann aber zunächst seine richtige räumliche Struktur einnehmen. In jeder Zelle gibt es dazu molekulare Helferproteine, genannt Chaperone. Sie passen auf die noch unreifen Proteine auf, helfen ihnen bei der Faltung und verhindern Fehler.
Forscher um Sebastian Hiller, Professor am Biozentrum der Universität Basel und Daniel Müller, Professor am Department Biosysteme (D-BSSE) der ETH Zürich in Basel, haben herausgefunden, wie zwei Chaperone im Darmbakterium E. coli das Membranprotein FhuA beim Transport beschützen und ihm beim Einfädeln in die Membran assistieren.
Chaperone helfen beim Einfädeln von Membranprotein
In der äusseren Membran von Bakterien sind unzählige Proteine eingebettet, die Nährstoffe und Signalmoleküle transportieren. Eines dieser membranständigen Transporter ist das Protein FhuA. Mithilfe dieses Proteins nehmen die Bakterien das für sie lebenswichtige Eisen, aber auch Antibiotika auf. Doch wie gelangt nun das sehr grosse, fassförmige FhuA-Protein unbeschädigt in die äussere Membran? Dieser Frage sind die Wissenschaftler vom Biozentrum und dem D-BSSE auf den Grund gegangen.
Um sich einen Weg in die äussere Membran zu ebnen, bedient sich FhuA der Hilfe zweier Chaperone. Mittels Strukturanalysen und Einzelmolekül-Kraftspektroskopie konnten die Forscher nun erstmals aufklären, wie die beiden Chaperone das noch unreife Protein stabilisieren und eine Fehlfaltung verhindern. «Dieser Vorgang ist überaus dynamisch», erklärt Hiller.
«Im Schutz der Chaperone wechselt FhuA ständig innerhalb tausendstel von Sekunden seine Struktur. So kann es energetisch günstige Zustände suchen, die das schrittweise Einfädeln einzelner Proteinabschnitte in die Membran erst ermöglichen.» Mit dem Einbau des letzten Abschnittes erhält FhuA dann seine reife, funktionstüchtige Fass-Struktur. Ungeschützt würde sich FhuA falsch falten und schliesslich verklumpen.
Protein-Chaos ohne Chaperone
Chaperone sind massgeblich an der Bildung funktionstüchtiger Proteine beteiligt. Sie spielen für die richtige Faltung löslicher Proteine eine wichtige Rolle, und sind darüber hinaus für den Einbau von komplexen Proteinmolekülen in die äussere Membran von Bakterien notwendig. Da verschiedene Organellen in pflanzlichen und tierischen Zellen bakteriellen Ursprungs sind, schützen auch hier Chaperone auf ähnliche Weise die Proteine und helfen beim Einbau. Den Studien kommt daher höchste Wichtigkeit zu für Krankheiten durch fehlgefaltete Proteine, wie Alzheimer, Parkinson oder Mukoviszidose.
«Dass Chaperone andere Proteine vor Fehlfaltung schützen und deren korrekte Faltung begünstigen, ist schon länger bekannt. Durch unsere Arbeit konnten wir nun erstmals an biologischen Zellen aufzeigen, wie Chaperone die für die Pharmaforschung wichtigen Membranproteine bei der Faltung unterstützen», erklärt ETH-Professor Daniel Müller. Bisher habe man dies fast ausschliesslich anhand künstlicher Umgebungen untersuchen können. Dadurch habe man jedoch kaum verstanden, wie sich Proteine in die Membran einer Zelle falten.
«Grob gesagt war es bisher so, als ob man eine Kuh aufs Eis stellt, um ihr natürliches Verhalten zu untersuchen, dann aber überraschende Reaktionen beobachtet, von denen wir nicht wissen können, ob sie ‹normal› sind», sagt Müller. «Wir verstehen nun besser, wie die Zelle ihre molekularen Maschinchen in die Zellmembran einbaut, so dass sie dort ihre Aufgaben erfüllen können.»
Originalbeitrag
Johannes Thoma, Björn M Burmann, Sebastian Hiller & Daniel J Müller
Impact of holdase chaperones Skp and SurA on the folding of ß-barrel outer-membrane proteins
Nature Structural & Molecular Biology (2015), doi: 10.1038/nsmb.3087
Weitere Auskünfte
Prof. Sebastian Hiller, Universität Basel, Biozentrum, Tel. +41 61 267 20 82, E-Mail: sebastian.hiller@unibas.ch
Prof. Daniel J. Müller, ETH Zürich, Departement Biosysteme, Tel. +41 61 387 33 07, E-Mail: daniel.mueller@bsse.ethz.ch
Media Contact
Weitere Informationen:
http://www.unibas.chAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















