Kein Eintritt ohne Proteinrecycling: RUB-Forscher entdecken neuen Zusammenhang bei Enzymtransport
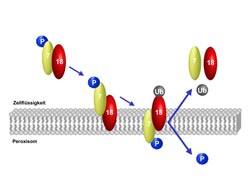
Modell des peroxisomalen Proteintransports: Der PTS2-Rezeptor erkennt bestimmte Proteine (P) in der Zellflüssigkeit und transportiert sie zur Oberfläche des Peroxisoms. Dabei binden sich die Proteine direkt an Pex7p (7), während Pex18p (18) den ersten Kontakt zur Membran herstellt. Entscheidend ist, dass Pex7p und sein Kargoprotein erst das Innere des Peroxisoms erreichen, wenn Pex18p mit dem Exportsignal Ubiquitin (Ub) durch die Export-Maschinerie (nicht gezeigt) modifiziert wurde. Ist die Modifikation erfolgt, wird das Kargoprotein über die Membran transportiert und Pex18p und Pex7p werden zurück in die Zellflüssigkeit befördert. Abbildung: Abteilung Systembiochemie der RUB<br>
Forscherinnen und Forscher der Ruhr-Universität Bochum um Prof. Dr. Ralf Erdmann (Medizinische Fakultät, Abteilung Systembiochemie) haben einen neuen Zusammenhang zwischen Import und Export von Proteinen der Peroxisomen entdeckt.
Im Journal of Biological Chemistry berichten sie, dass Enzyme erst in das Innere bestimmter Zellorganellen (Peroxisomen) gelangen, wenn sichergestellt ist, dass ihr Transportprotein (Rezeptor) recycelt wird. Bisher ging man davon aus, dass es sich um getrennte Vorgänge handelt.
Multifunktionswerkzeug Peroxisom
Peroxisomen verfügen über keine eigene DNA. Damit sie trotzdem ihre Aufgabe erfüllen können, sind alle notwendigen Proteine im Zellkern codiert und werden ins Peroxisom importiert. Die Bochumer Mediziner erforschen, wie genau dieser Vorgang abläuft. Insgesamt enthalten Peroxisomen über 50 verschiedene Enzyme, die z.B. Fettsäuren abbauen, Wasserstoffperoxid entsorgen oder auch Plasmalogene, den Hauptbestandteil der weißen Substanz im Gehirn, bilden. Sind sie in ihrer Funktion gestört, verursacht dies nicht nur schwere Stoffwechselstörungen, sondern kann bei Neugeborenen sogar zum Tod führen.
Exportsignal steuert Recycling
Dynamische Rezeptoren erkennen und eskortieren die für das Peroxisom bestimmten Enzyme zur Organelle und verbinden sich dort mit der Membran. Dann löst sich der Rezeptor-Enzym-Komplex auf und das Enzym gelangt in das Innere des Peroxisoms. Der Rezeptor wird aus der Membran heraus wieder in die Zellflüssigkeit transportiert und dort von neuem eingesetzt. Gesteuert wird dieses Recycling durch ein Exportsignal, das Proteinelement Ubiquitin, welches an den Rezeptor andockt.
Modifikation als Sicherheitsbarriere
Erdmanns Team untersuchte das PTS2-Rezeptor-Modul, das aus einer Zielsteuerungseinheit (Pex18p) und einer Enzym-Bindeeinheit (Pex7p) besteht. Hierbei stellten die Wissenschaftler fest, dass Ubiquitin Pex18p so modifiziert, dass es dem Rezeptor möglich ist in die Zellflüssigkeit zurückzukehren. Erst nach dieser Modifikation tritt die Enzym-Bindeeinheit in die Organelle ein und das transportierte Enzym gelangt in das Peroxisom. „Die enge Kopplung dieser beiden augenscheinlich entgegengesetzt wirkenden Schritte, eröffnet gänzlich neue Ansätze für die Frage, wie Proteine über Membranen transportiert werden“, so Erdmann.
Titelaufnahmen
A. Hensel, S. Beck, F. El Magraoui, H.W. Platta, W. Girzalsky, R. Erdmann (2011): Cysteine-dependent ubiquitination of Pex18p is linked to cargo translocation across the peroxisomal membrane, Journal of Biological Chemistry, doi: 10.1074/jbc.M111.286104
W. Schliebs, W. Girzalsky, R. Erdmann (2010): Peroxisomal protein import and ERAD: variations on a common theme, Nature Reviews Molecular Cell Biology, doi: 10.1038/nrm3008
Weitere Informationen
Prof. Dr. Ralf Erdmann, Abteilung Systembiochemie, Medizinische Fakultät der Ruhr-Universität, 44780 Bochum, Tel.: 0234/32-24943
Ralf.Erdmann@rub.de
Angeklickt
Systembiochemie an der RUB
http://www.ruhr-uni-bochum.de/physiolchem/system/
Frühere Presseinformation zum Thema
http://aktuell.ruhr-uni-bochum.de/pm2011/pm00233.html.de
Redaktion: Marie-Astrid Reinartz
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















