Ein Einwegtor für Proteine

Damit eine Nervenzelle richtig funktioniert, muss jedes Protein am richtigen Ort sein. Das Protein Tau zum Beispiel gehört in die Axone – in die langen Ausläufer der Nervenzellen.
Ein frühes Kennzeichen einer ganzen Reihe von neurodegenerativen Erkrankungen, wie auch der Alzheimer-Krankheit, ist eine Fehllokalisation von Tau – es verlässt die Axone und sammelt sich im Zellkörper an.
Wissenschaftler vom Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und Forschungszentrum caesar unter der Leitung von Prof. Eckhard Mandelkow haben nun eine Erklärung für diese Störung gefunden. Sie haben einen neuen zellulären Mechanismus entdeckt, der in gesunden Zellen das Tau-Protein in den Axonen hält und zeigen, wie dieses System bei bestimmten Erkrankungen außer Kraft gesetzt wird.
„Der Mechanismus funktioniert wie eine Art Einwegtor am Axoneingang, durch das Tau zwar in die Axone hinein, aber nicht wieder heraus kommt“, so Mandelkow. „Bei Alzheimer und anderen so genannten Tauopathien ist Tau so verändert, dass es dieses Tor von beiden Seiten passieren kann“. Die Arbeiten wurden am 18.10.2011 in der Zeitschrift EMBO Journal online veröffentlicht.
„Tauopathien“ ist ein Überbegriff für eine Reihe von neurodegenerativen Erkrankungen, deren prominentester Vertreter die Alzheimer-Krankheit ist. In gesunden Zellen ist Tau in den Axonen angereichert – Zellfortsätzen, über die Nervenzellen Signale an nachgeschaltete Zellen weiterleiten. Bei Tauopathien hingegen verteilt sich das Protein im gesamten Zellkörper und in den Dendriten, den Empfängern von neuronalen Signalen. Diese Fehllokalisation von Tau ist ein erster und sehr entscheidender Schritt in der Pathologie der Krankheiten. In früheren Arbeiten haben die Forschergruppen von Eva und Eckhard Mandelkow Hinweise darauf gefunden, dass eine Anreicherung von Tau in den Dendriten eine Störung der neuronalen Kontakte zur Folge hat und die Signalübertragung zwischen Nervenzellen beeinträchtigt. Dies wiederum führt langfristig dazu, dass die Zellen degenerieren und absterben. Die Wissenschaftler um Mandelkow wollten daher genauer wissen, wie Tau in gesunden Zellen im Axon gehalten wird und warum dieser Prozess in Tauopathien nicht funktioniert.
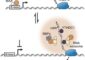
Um dies zu erforschen, nutzten die Wissenschaftler eine neue Technologie, mit der die Verteilung von Proteinen innerhalb einer Zelle genau verfolgt werden kann. Dazu koppelten sie das Tau-Protein an einen fotoaktivierbaren Fluoreszenzfarbstoff und schleusten es in Nervenzellen ein. Wird nun ein bestimmter Bereich der Zelle kurz mit einem Laser angeregt, ändern sich dort die Fluoreszenzeigenschaften des Tau-Proteins von grün nach rot, so dass seine weitere Verbreitung innerhalb der Zelle beobachtet werden kann. Wenn Tau einmal im Axon ist, so zeigten die Forscher, sitzt es dort quasi fest. Genau am Axoneingang, wo das Axon vom Zellkörper abzweigt, entdeckten die Wissenschaftler eine Barriere, die das Tau-Protein daran hindert, vom Axon zurück in den Zellkörper zu gelangen.
In gesunden Zellen bindet Tau in den langen Axonen der Zelle an die Mikrotubuli, Bestandteile des stützenden Zytoskellets, und stabilisiert diese. Bei der Alzheimer-Erkrankung und anderen Tauopathien wird Tau zu stark mit Phosphatgruppen bestückt. Durch diese Phosphorylierung löst es sich von den Mikrotubuli ab.
Wird dadurch die Fehllokalisation von Tau in den Zellkörper hervorgerufen? Könnte es sein, dass nur fest an Mikrotubuli gebundenes Tau die Schranke am Axoneingang respektiert? Durch weitere Experimente beantworteten die Forscher diese Fragen eindeutig mit „Ja“ – Tau, das zu stark phosphoryliert ist, ist in der Lage, das Axon zu verlassen und sich im Zellkörper zu anzuhäufen. „Schon lange weiß man, dass bei Tauopathien das Tau-Protein falsch sortiert wird. Auch dass Tau bei diesen Erkrankungen zu viele Phosphatgruppen erhält, ist schon länger bekannt. Unsere Arbeiten zeigen nun, dass diese beiden Prozesse zusammenhängen. Tau wird falsch sortiert, weil es zu stark phosphoryliert wird“, so Mandelkow. Weitere Studien werden versuchen die zugrunde liegende Ursache der Hyperphosphorylierung zu erklären.
Originalpublikation:
Xiaoyu Li, Yatender Kumar, Hans Zempel, Eva-Maria Mandelkow, Jacek Biernat and Eckhard Mandelkow. Novel diffusion barrier for axonal retention of Tau in neurons and its failure in neurodegeneration. The EMBO Journal, online veröffentlicht am 18.10.2011. doi:10.1038/emboj.2011.376
Kontaktinformation:
Dr. Katrin Weigmann
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Presse- und Öffentlichkeitsarbeit
Tel: +49 228 43302 /263
Mobil: +49 173 – 5471350
Email: katrin.weigmann@dzne.de
Media Contact
Weitere Informationen:
http://www.dzne.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…