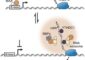
Detaillierter Blick auf molekularen Gifttransporter

Das Transportprotein ABCG2 (Mitte) ist in die Zellmembran eingebettet. Es erkennt im Zellinnern (unten) über 200 Stoffe und transportiert diese nach aussen (oben). ETH Zürich / Scott Jackson, Ioannis Manolaridis, Kaspar Locher
Fast alle Lebewesen haben im Lauf der Evolution Mechanismen entwickelt, um Giftstoffe, die ins Innere ihrer Zellen gelangt sind, wieder loszuwerden: In der Zellmembran sitzen molekulare Pumpen, die schädliche Stoffe im Zellinnern erkennen und nach aussen spedieren.
Forschende der ETH Zürich und vom Biozentrum der Universität Basel haben nun die dreidimensionale Struktur eines solchen Transportproteins beim Menschen – des Proteins ABCG2 – auf atomarer Ebene aufgeklärt.
Es ist dies die erste solche Struktur für einen menschlichen multispezifischen Arzneistofftransporter (engl. multi-drug transporter), die nun bekannt ist. Die Wissenschaftler veröffentlichten ihre Arbeit in der jüngsten Ausgabe des Fachmagazins Nature.
«Das Protein ABCG2 erkennt und transportiert mindestens 200 bekannte Stoffe», erklärt Kaspar Locher, Professor für Molekulare Membranbiologie an der ETH Zürich und Leiter der Studie. Zu diesen Stoffen gehören Alkaloide – Pflanzeninhaltsstoffe, die wir über die Nahrung aufnehmen –, aber auch körpereigene Stoffe wie Harnsäure oder der Hämoglobin-Abbaustoff Bilirubin.
Aktiv ist das Protein unter anderem in der Darmwand, wo es schädliche Stoffe daran hindert, ins Blut zu gelangen, oder in den Zellen der Blut-Hirn-Schranke, wo es Giftstoffe vom Gehirn fernhält. Bedeutend sind Proteine wie ABCG2 auch in Milchdrüsen und in der Plazenta. Dort sorgen sie dafür, dass Giftstoffe nicht in die Muttermilch gelangen oder in den Blutkreislauf eines ungeborenen Kindes.
Zweischneidiges Schwert
Allerdings hat die Funktion von multispezifischen Arzneistofftransportern eine Kehrseite: Die Proteine pumpen auch gewisse Medikamente aus den Zellen und verhindern so, dass diese im Zellinnern wirken. «Bei der Entwicklung von Medikamenten muss daher immer untersucht werden, ob sie von Transportproteinen wie ABCG2 erkannt werden», sagt Locher.
Medikamente, die oral verabreicht werden, müssen die Darmwand durchdringen, und solche, die im Gehirn wirken sollen, müssen die Blut-Hirn-Schranke passieren. Sie können dies nur, wenn ABCG2 sie nicht erkennt.
Von einigen Krebsmedikamenten (Chemotherapeutika) hingegen ist bekannt, dass ABCG2 sie erkennt. Dies ist gravierend, weil gewisse Tumorzellen in der Lage sind, die Zahl der ABCG2-Proteine in ihrer Zellmembran zu erhöhen. Solchen Zellen pumpen Chemotherapeutika effizient nach aussen – sie sind gegen die Medikamente resistent.
Medikamentenentwicklung mit dem Computer
Dank der nun bekannten Struktur von ABCG2 könnten Wissenschaftler künftig am Computer simulieren, ob das Transportprotein neue Arzneimittel erkennen kann. Ebenfalls mithilfe von Computermodellierungen könnten Forschende bessere Antikörper für die Diagnose medikamentenresistenter Krebszellen entwickeln oder Wirkstoffe, welche das Transportprotein hemmen.
Mit solchen Wirkstoffen könnten bestimmte Resistenzen gegenüber Chemotherapeutika überwunden werden. «Die Beiträge unserer Forschung für die Medizin und insbesondere die Krebsmedizin sind jedoch längerfristig zu sehen. Wir liefern in erster Linie die Grundlage», betont Locher.
ABCG2 ist ein sehr bewegliches Molekül. Es war deshalb schwierig, das Molekül für die Aufklärung seiner atomaren Struktur festzuhalten. Mithilfe von stabilisierenden Antikörpern ist es den Wissenschaftlern jedoch gelungen, das Protein zu immobilisieren.
Die dreidimensionale Struktur bestimmten die ETH-Forschenden in Zusammenarbeit mit Henning Stahlberg, Professor am Biozentrum der Universität Basel, und seiner Gruppe mittels der Kryo-Elektronenmikroskopie.
«Wir haben in der letzten Zeit intensiv daran gearbeitet, unsere Elektronenmikroskope in deren Auflösungsvermögen zu optimieren und gleichzeitig weitgehend zu automatisieren. So haben wir eine unglaublich schnelle Analysepipeline geschaffen», sagt Stahlberg.
Die Kryo-Elektronenmikroskopie ist eine verhältnismässig neue Technologie zur Aufklärung atomarer Molekülstrukturen. «Die Technik hat in der Strukturbiologie eine Revolution ausgelöst», sagt Locher. In Anbetracht dieser Bedeutung wird die ETH Zürich weiter in die Methode investieren und am Mikroskopiezentrum ScopeM ein zweites hochauflösendes Kryo-Elektronenmikroskop anschaffen. Es wird allen Wissenschaftlern der Life Sciences zur Verfügung stehen, um Moleküle und Strukturen mit atomarer Auflösung zu untersuchen.
Die Studie wurde finanziert vom Nationalen Forschungsschwerpunkt (NFS) Transcure [http://www.nccr-transcure.ch].
Literaturhinweis
Taylor NMI, Manolaridis I, Jackson SM, Kowal J, Stahlberg H, Locher KP: Structure of the human multidrug transporter ABCG2. Nature, 29. Mai 2017, doi: 10.1038/nature22345 [http://dx.doi.org/10.1038/nature22345]
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge
Forschende enthüllen neue Funktion von Onkoproteinen
Forschende der Uni Würzburg haben herausgefunden: Das Onkoprotein MYCN lässt Krebszellen nicht nur stärker wachsen, sondern macht sie auch resistenter gegen Medikamente. Für die Entwicklung neuer Therapien ist das ein…

Mit Kleinsatelliten den Asteroiden Apophis erforschen
In fünf Jahren fliegt ein größerer Asteroid sehr nah an der Erde vorbei – eine einmalige Chance, ihn zu erforschen. An der Uni Würzburg werden Konzepte für eine nationale Kleinsatellitenmission…

Zellskelett-Gene regulieren Vernetzung im Säugerhirn
Marburger Forschungsteam beleuchtet, wie Nervenzellen Netzwerke bilden. Ein Molekülpaar zu trennen, hat Auswirkungen auf das Networking im Hirn: So lässt sich zusammenfassen, was eine Marburger Forschungsgruppe jetzt über die Vernetzung…