Blaues Blut des Kaiserskorpions durchleuchtet
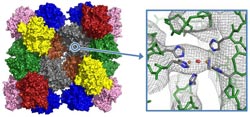
Hämocyanin des Kaiserskorpions<br>Abb.: Jaenicke E et al (2012), PLoS One<br>
Der Kaiserskorpion (Pandinus imperator) gehört nicht nur zu den größten Skorpionen überhaupt, sondern fällt auch durch die ungewöhnliche Größe eines Proteins aus dem Rahmen. Sein Blutfarbstoff Hämocyanin ist ein Proteinkomplex aus 24 Untereinheiten und gehört zu den größten Proteinen – vergleichbar dem Ribosom oder sogar kleinen Viren.
Mainzer Wissenschaftlern ist es nun erstmals gelungen, Kristalle des Kaiserskorpion-Hämocyanins zu züchten. Damit kann eine genaue Strukturanalyse mit Hilfe von Röntgenstrahlen durchgeführt werden. Bisher werden sehr große Proteinstrukturen wie die des Hämocyanins meist durch Elektronenmikroskopie untersucht, die allerdings aus methodischen Gründen keine Auflösung erreichen, um einzelne Atome zu unterschieden. Mit der Röntgenkristallographie kann die Struktur von Proteinen jedoch noch genauer erforscht und im günstigsten Fall die räumliche Anordnung einzelner Atome ermittelt werden. Das ist die Voraussetzung, um zu verstehen, wie diese riesigen Proteinkomplexe funktionieren.
Hämocyanine sind außerordentlich große Atmungsproteine, die bei Weichtieren und Gliederfüßern den Sauerstoff im Blut transportieren. Der Sauerstoff bindet bei diesen blauen Blutproteinen zwischen zwei Kupferatomen, während er bei Menschen in den roten Blutkörperchen an Eisen andockt. Das Faszinierende an Hämocyanin ist für die Biologen, dass zur Aufnahme von Sauerstoff, für seinen Transport und die Abgabe je nach Tierart bis zu 160 Sauerstoffbindungszentren in einem Proteinkomplex miteinander kommunizieren. Diese als Kooperativität bezeichnete Eigenschaft, die beispielsweise in der Nanotechnologie angewendet werden könnte, um molekulare Schalter zu bauen, ist in der Natur einmalig – und kann im Detail nur durch Strukturaufklärung mit atomarer Auflösung verstanden werden.
Am Institut für Biophysik der Johannes Gutenberg-Universität Mainz ist es nun Prof. Dr. Elmar Jaenicke erstmals gelungen, den blauen Hämocyanin-Proteinkomplex des Kaiserskorpions zu kristallisieren. Dies ist der entscheidende erste Schritt zur Röntgenstrukturaufklärung, denn Kristalle sind die Voraussetzung dafür, dass die Röntgenstrahlung richtig gebeugt wird und die Struktur entschlüsselt werden kann. Die Kristallisation ist bei sehr großen Proteinkomplexen besonders schwierig. „Es ist ein bisschen ein Glücksspiel“, sagt Jaenicke über das Kristallisationsverfahren, das von vielen Faktoren wie zum Beispiel dem ph-Wert, dem Salzgehalt der Lösung und der Temperatur abhängig ist. „Der entscheidende Schritt ist immer die Bildung eines Kristallisationskeims.“ Jaenicke zufolge kann das allerdings Monate dauern und erfordert viel Geduld. Manchmal zieht sich die Optimierung der Kristallisationsbedingungen über mehrere Jahre hin. Dies ist auch der Grund warum bisher weltweit nur eine Handvoll Strukturen von sehr großen Proteinkomplexen mit Röntgenstrukturaufklärung gelöst wurde. Eine davon, die des Ribosoms, wurde 2009 mit dem Nobelpreis ausgezeichnet.
Die Kristalle werden im Röntgenstrahl vermessen und die Struktur in einem aufwendigen Verfahren aus der gestreuten Röntgenstrahlung berechnet. Im Fall des Kaiserskorpion-Proteins gelang es den Wissenschaftlern um Jaenicke vorerst, eine Struktur mittlerer Auflösung (6,5 Ångström) zu erhalten, bei der man Sekundärstrukturelemente wie α-Helices sehen kann, aber beispielsweise noch keine einzelnen Aminosäuren. Zum Vergleich: Wäre das Protein ein Backsteinhaus und man würde seine Struktur aus großer Entfernung mit dem Fernrohr ermitteln wollen, dann wären bei der jetzigen Auflösung Fenster, Türen und auch der Briefkasten sichtbar, aber noch nicht die Lage von einzelnen Backsteinen. „Wir haben einen Anfangspunkt gesetzt und können jetzt schon Teile des aktiven Zentrums des Moleküls sehen. Nun sind wir auf dem Weg, mit einer weiteren Verbesserung unserer Kristalle auch eine atomare Auflösung zu erzielen, was mit keiner anderen Methode möglich ist.“ Laut Jaenicke würde das Sauerstoffbindungsprotein des Kaiserskorpions dann zu den fünf größten Strukturen gehören, die bis heute mit Röntgenstrukturanalyse aufgeklärt worden sind.
An der Johannes Gutenberg-Universität Mainz besteht eine ideale Infrastruktur zur Strukturforschung an sehr großen Proteinkomplexen, die in dieser Form nur an wenigen Forschungseinrichtungen weltweit betrieben werden kann. Dabei wird mit der Röntgenstrukturaufklärung am Institut für Molekulare Biophysik (AG Decker, AG Jaenicke) der atomare Auflösungsbereich und mit der Cryo-Elektronenmikroskopie am Institut für Zoologie (AG Markl) der mittlere Auflösungsbereich abgedeckt. Die am Institut für Molekulare Biophysik verwendete neue Röntgen-Drehanode produziert fokussierte Röntgenstrahlung, die von der Intensität mit einer Synchrotron-Beamline der zweiten Generation vergleichbar und somit ideal geeignet ist, um in die Struktur von Riesenmolekülen vorzudringen.
Abbildung:
Hämocyanin des Kaiserskorpions (Modell des 24-meren Proteinkomplexes und Elektronendichte am aktiven Zentrum, an dem der Sauerstoff gebunden wird)
Quelle: Jaenicke E et al (2012), PLoS One 7(3):e32548
Veröffentlichung:
Elmar Jaenicke, Bruno Pairet, Hermann Hartmann, Heinz Decker
Crystallization and Preliminary Analysis of Crystals of the 24-Meric Hemocyanin of the Emperor Scorpion (Pandinus imperator)
PLoS ONE, 5. März 2012
DOI:10.1371/journal.pone.0032548
Weitere Informationen:
Prof. Dr. Elmar Jaenicke
Institut für Molekulare Biophysik
Johannes Gutenberg-Universität Mainz (JGU)
D 55099 Mainz
Tel. +49 6131 39-23567
Fax +49 6131 39-23557
E-Mail: elmar.jaenicke@uni-mainz.de
Media Contact
Weitere Informationen:
http://www.biophysik.uni-mainz.de/jaenicke.phpAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















