Molekulare Wirkungsweise eines Naturgiftes entschlüsselt
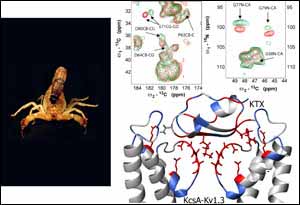
Untersuchung der Struktur eines Toxin-Ionenkanal-Komplexes. Mittels Festkörper-NMR wurde untersucht, welche Wirkung Kaliotoxin, das Gift eines nordafrikanischen Skorpions (Bild links), auf einen bakteriellen Kalium-Kanal hat. Durch Analyse der Festkörper-NMR Daten der spin-markierten Proben vor und nach der Komplexbildung (rot bzw. grün, Bild oben) haben die Forscher ein strukturelles Modell der Bindungstasche entwickelt (Bild unten). Das Toxin beziehungsweise die rot markierten Bereiche des Kanalporteins werden bei der Bindung beeinflusst, die blauen Bereiche nicht. Bild: Max-Planck-Institut für biophysikalische Chemie/ZMNH
Internationales Forscherteam macht erstmals sichtbar, wie Giftstoffe an Kaliumkanäle binden und deren interne Struktur verändern
Bisse und Stiche von Schlangen, Spinnen und Skorpionen sind oft tödlich. Dabei werden im Körper des Opfers Giftstoffe freigesetzt, die dann an Ionenkanäle in der Zellmembran binden. Was genau dabei passiert, haben jetzt Wissenschaftler des Max-Planck-Instituts für biophysikalische Chemie zusammen mit deutschen und französischen Kollegen aufgedeckt. Mit einer Kombination aus magnetischer Resonanzspektroskopie (Festkörper-NMR) mit speziellen Protein-Syntheseverfahren konnten sie zeigen, dass sich sowohl die Struktur des Kaliumkanals selbst als auch des Toxins ändert, wenn diese sich zu einem Komplex verbinden. Diese Befunde könnten helfen, wirksamere Medikamente gegen Bluthochdruck und andere Krankheiten zu entwickeln, die mit Fehlfunktionen von Kalium-Kanälen zusammenhängen (Nature, 13. April 2006).
Die Zellen unseres Körpers sind von Membranen umgeben, in die wiederum Ionenkanäle eingebettet sind. Hierbei handelt es sich um spezielle Proteine, die es ganz bestimmten Ionen erlauben, die Zellmembran zu durchqueren. Dadurch baut sich ein elektrochemisches Gefälle auf, so dass Signale von Nerven- oder Herzmuskelzellen weitergeleitet werden können. Wird eine solche Zelle erregt, ändert sich die Struktur ihrer Ionenkanäle: Diese bilden Poren, durch die Ionen passieren können. So gibt es beispielsweise Kalium-Kanäle, also Proteine, die nur für Kalium-Ionen durchlässig sind. Deshalb sind sie Angriffsziel hochspezifische Toxine vieler giftiger Tiere. Diese Toxine interagieren mit den Kalium-Kanälen in den Zellen des Opfers, so dass elektrische Signale nicht mehr weitergeleitet werden, was oft zum Tode führt.
Solche Wechselwirkungen sind auf struktureller Ebene bisher nur unzureichend untersucht, obwohl man mithilfe der Röntgenkristallographie bereits große Fortschritte bei der Erforschung der Ionenkanäle erzielt hat. Deshalb haben sich die Wissenschaftler vom Max-Planck-Institut für biophysikalische Chemie in Göttingen zusammen mit Forschern des Instituts für Neurale Signalverarbeitung in Hamburg und französischen Kollegen der Universität Marseille etwas einfallen lassen: Sie kombinierten neue Methoden der magnetischen Resonanzspektroskopie (Festkörper-NMR) mit bestimmten Protein-Syntheseverfahren und untersuchten am Beispiel des Gifts des nordafrikanischen Skorpions Androctonus mauretanicus mauretanicus, wie bakterielle Kalium-Kanäle mit einem Toxin auf atomarer Ebene in Wechselwirkung treten.
Nach der elektrophysiologischen Charakterisierung des „vergifteten“ Kanalproteins stellten die Forscher davon spin-markierte Proteine her und untersuchten diese dann mittels Zweidimensionaler Festkörper-NMR. Die Kohlenstoff- und Stickstoffatome solcher Proteine besitzen ein intrinsisches magnetisches Moment (spin), das der Signalverstärkung im NMR dient. Die Forscher verglichen dann die spektroskopischen Daten vor und nach der Einwirkung des Toxins auf den Kanal. Dabei zeigte sich, dass das Gift an einen ganz bestimmten Bereich des Kanals – die Porenregion – bindet und deren Struktur verändert. Doch auch die NMR-Signale des Toxins hatten sich verändert. Das deutet darauf hin, dass es nur dann wirksam ist, wenn es eine bestimmte Aminosäuresequenz des Ionenkanals erkennt. Auch die intrinsische Flexibilität der Bindungspartner spielt dabei eine wichtige Rolle: Für eine starke Wechselwirkung der Moleküle müssen beide Partner offensichtlich in der Lage sein, ihre Struktur zu verändern.
Die angewandten neuen spektroskopischen Methoden leisten einen wichtigen Beitrag zum Verständnis der Pharmakologie und Physiologie von Kalium-Kanälen und könnten helfen, wirksamere und zugleich spezifischere Medikamente herzustellen.
[MB/AT/LM]
Originalveröffentlichung:
Adam Lange, Karin Giller, Söhnke Hornig, Marie-France Martin-Eauclaire, Olaf Pongs, Stefan Becker, Marc Baldus
Toxin-induced conformational changes in a potassium channel revealed by solid-state NMR
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















