Forscher klären Arbeitsweise des Spir-Proteins
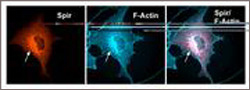
Das an der Uni Würzburg entdeckte Spir-Protein bringt die Bildung von Aktinfasern (F-Aktin) in Gang. Es wurde in Säugerzellkulturen hergestellt, seine Lokalisation in der Zelle mit fluoreszierenden Antikörpern sichtbar gemacht (rote Farbe). Das Protein befindet sich in der Nähe des bohnenförmig erscheinenden Zellkerns am so genannten trans-Golgi-Netzwerk (weißer Pfeil). Parallel wurden auch die Aktinfasern angefärbt (blau). Bild: Kerkhoff
Bericht in „Nature“: Neuer grundlegender zellbiologischer Mechanismus gefunden
Nach der Entdeckung des Spir-Proteins in der Arbeitsgruppe von Eugen Kerkhoff an der Uni Würzburg ist es nun gelungen, die biochemische Funktion des Proteins aufzuklären. Über diese jüngsten Erkenntnisse berichtet die Top-Zeitschrift „Nature“. Die Würzburger Zellforscher haben mit amerikanischen Kollegen herausgefunden, dass das Spir-Protein in der Zelle eine wichtige Arbeit verrichtet: Es vermittelt die Bildung so genannter Aktin-Filamente. Außerdem hegen sie den Verdacht, dass es bei Brustkrebs und beim Wachstum von Nervenzellen eine Rolle spielt.
Das von Kerkhoffs Doktorandin Ines Otto vor fünf Jahren entdeckte Spir-Protein leitet die Polymerisation von Aktin ein. Dieses kugelförmige Protein ist entscheidend an der Zellgestalt und der Zellbewegung beteiligt. Bei der Polymerisation werden einzelne Aktin-Moleküle zu langen Strängen verknüpft – dadurch können Zellen ihre Struktur verändern, sich fortbewegen oder in ihrem Inneren Stoffe transportieren.
Die Polymerisation läuft nicht von alleine ab. Bislang kannte die Wissenschaft zwei Mechanismen, die sie anstoßen, wie Kerkhoff erklärt. Doch nun ist ein dritter Weg aktenkundig, der über das Spir-Protein verläuft. Zuerst bindet das Protein vier einzelne Aktin-Kugeln an sich. Auf diese Weise entsteht ein Keim, an den sich weitere Kugeln anlagern können. Diesen Vorgang der Strangbildung beschreiben die Würzburger Forscher mit ihren Kollegen aus San Francisco und St. Louis detailliert in „Nature“.
Spir befindet sich in der Zelle immer in der Nähe von Membran-Bläschen, den so genannten Vesikeln, die dem Materialtransport dienen. „Wir vermuten, dass der vom Spir-Protein aus wachsende Strang den Antrieb für die Bläschen darstellt, dass er sie sozusagen vorwärts schiebt“, so Kerkhoff.
Gewissheit dagegen herrscht bei den Forschern darüber, dass Zellen ohne das Spir-Protein ihre Polarität verlieren. Polarität bedeutet, dass Zellen nicht rundum gleich sind, sondern dass es vorne und hinten, unten und oben gibt. Das ist etwa bei den so genannten Epithelzellen der Fall: Sie bedecken Oberflächen, kleiden den Darm oder die Blutgefäße aus. Verlieren solche Zellen ihre Polarität, dann ist das oft der erste Schritt zur Krebsentstehung, wie der Würzburger Forscher sagt.
Denkbar wäre also, dass ein Schaden am Spir-Protein die Polarität einer Zelle aufhebt und diese zur Krebszelle entarten lässt. Interessant in diesem Zusammenhang: Bei 20 Prozent aller Brustkrebspatientinnen werden im Blut Antikörper gefunden, die sich gegen eines der zwei beim Menschen bekannten Spir-Proteine richten. Diesen Zusammenhang zwischen dem Protein und Brustkrebs erforscht Kerkhoff nun in Kooperation mit Ulf R. Rapp und Johannes Dietl von der Frauenklinik der Uni Würzburg. Die Sander-Stiftung (München) fördert das Projekt.
Außerdem widmen sich die Wissenschaftler am Institut für Medizinische Strahlenkunde und Zellforschung einem weiteren Aspekt: „Wir untersuchen auch, welche Rolle Spir bei der Entwicklung der Nervenzellen und im Gehirn spielt“, so Kerkhoff. Denn auch hier mischt das Protein offenbar kräftig mit, und auch bei Nervenzellen spielt die Polarität eine große Rolle. Fünf Jahre nach der Entdeckung des Proteins stehen die Würzburger Forscher also noch vor genug Fragen, die einer Antwort harren.
Weitere Informationen:
PD Dr. Eugen Kerkhoff, T (0931) 201-45868, Fax (0931) 201-45835, E-Mail: kerkhoff@mail.uni-wuerzburg.de
Margot E. Quinlan, John Heuser, Eugen Kerkhoff, R. Dyche Mullins: „Drosophila Spir is an actin nucleation factor“, Nature Vol. 433, 27. Januar 2005, Seiten 382-388.
Media Contact
Weitere Informationen:
http://www.uni-wuerzburg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge
Forschende enthüllen neue Funktion von Onkoproteinen
Forschende der Uni Würzburg haben herausgefunden: Das Onkoprotein MYCN lässt Krebszellen nicht nur stärker wachsen, sondern macht sie auch resistenter gegen Medikamente. Für die Entwicklung neuer Therapien ist das ein…

Mit Kleinsatelliten den Asteroiden Apophis erforschen
In fünf Jahren fliegt ein größerer Asteroid sehr nah an der Erde vorbei – eine einmalige Chance, ihn zu erforschen. An der Uni Würzburg werden Konzepte für eine nationale Kleinsatellitenmission…

Zellskelett-Gene regulieren Vernetzung im Säugerhirn
Marburger Forschungsteam beleuchtet, wie Nervenzellen Netzwerke bilden. Ein Molekülpaar zu trennen, hat Auswirkungen auf das Networking im Hirn: So lässt sich zusammenfassen, was eine Marburger Forschungsgruppe jetzt über die Vernetzung…