Forscher lassen Muskelmotor rückwärts laufen
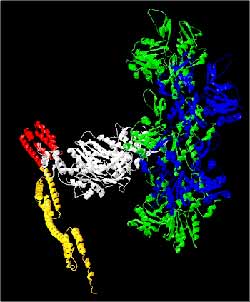
Modell eines künstlichen, "rückwärtslaufenden" Motors, der an F-Aktin gebunden ist. Das künstliche Motorprotein besteht aus der Motordomäne eines Klasse-1 Myosins (grau), einem 4-Helixbündel-Bereich aus dem human Guanylate Binding Protein-1 (rot) und zwei Actinin-Wiederholungseinheiten (orange). Das gezeigte Aktinfilament besteht aus fünf Monomeren (grün und blau).
Wissenschaftlern aus Hannover und Heidelberg ist es erstmals gelungen, die Bewegungsrichtung eines biologischen Motorproteins gezielt umzukehren
Spezielle Proteine mit gewünschten Eigenschaften maßschneidern zu können, ist ein wichtiges Ziel der Bio- und Nanotechnologie. Von besonderem Interesse ist hierbei Myosin, ein winziger molekularer Motor, der auch unsere Muskeln bewegt. Forscher der Medizinischen Hochschule Hannover (MHH) und des Heidelberger Max-Planck-Instituts für medizinische Forschung haben jetzt erstmals einen nur wenige Nanometer großen „künstlichen“ Myosin-Motor aus drei molekularen Bausteinen zusammengebaut, der sich gezielt rückwärts bewegen kann (Nature, 5. Februar 2004). Dieser Erfolg hat Bedeutung für die Biotechnologie sowie die molekulare Medizin und Analytik.
Molekulare Motoren erzeugen Kraft und verrichten mechanische Arbeit in lebenden Zellen. Die erforderliche Energie beziehen sie aus dem Abbau von ATP (Adenosintriphosphat). Generell unterscheidet man bei diesen biologischen Antrieben zwischen Rotationsmotoren, wie beispielsweise dem ATP-prodzierenden Enzym F1F0-ATPase in Mitochondrien oder dem bakteriellen Flagellenantrieb, sowie Linearmotoren, die sich über die „schienenähnlichen“ Aktinfilamente oder Mikrotubuli des Zytoskeletts im Innern einer Zelle bewegen. Diese molekularen Motoren bilden die Grundlage für fast alle biologischen Bewegungen und ermöglichen es subzellulären Strukturen, ganzen Zellen oder sogar Organismen, sich gerichtet zu bewegen.
Die Myosine gehören zu einer außerordentlich großen Familie von molekularen Linearmotoren, die Kraft und Bewegung entlang von polaren Aktinfilamenten in der Zelle erzeugen. Myosine bestehen aus drei Domänen mit jeweils spezifischer Funktion: Über die etwa acht Nanometer große „Motordomäne“ findet die Wechselwirkung mit Aktin und ATP statt. Die Motordomäne ist der am stärksten konservierte Bereich des Myosins und enthält als Strukturelemente ein siebensträngiges Faltblatt mit einigen darum herum gefalteten Helices. In der „Nackenregion“ von Myosin, die als Hebelarm funktionieren kann, befinden sich Bindungsstellen für Calmodulin oder Calmodulin-ähnliche Proteine. Die carboxyterminale „Schwanzdomäne“ schließlich zeigt die stärkste Vielfalt und für die einzelnen Myosinklassen typische Unterschiede.
Um Motorproteine, wie das Myosin, verstehen und letztlich auch künstlich beeinflussen zu können, nutzt man in der Forschung ein breites Methodenspektrum, vom computergestützten Proteindesign über die gentechnische Produktion, Röntgenstrukturanalyse und kinetische Untersuchungen bis hin zur direkten Messung der Bewegungsaktivität und Kraftentfaltung einzelner Motormoleküle. Den Forschern der MHH und des Heidelberger Max-Planck-Instituts ist es nun mit einem eigens dazu entwickelten Methodenmix gelungen, aus rekombinanten Motorproteinen mit gezielt veränderten Eigenschaften einen „rückwärtslaufenden“ Motor zusammen zu bauen.
Der neue molekulare Motor besteht aus drei unabhängigen Bausteinen: einer „vorwärtslaufenden“ Motordomäne eines Klasse-1 Myosins, einem 4-Helixbündel-Bereich aus human Guanylate Binding Protein-1 sowie zwei Actinin-Wiederholungseinheiten (s. Abbildung 2). Die langen, starren Actinin-Wiederholungseinheiten dienen dabei als künstlicher Hebelarm, der kleine Konformationsänderungen innerhalb der Motordomäne verstärkt und dadurch Bewegungen mit einer Amplitude von etwa 10 Nanometer erzeugt. Der 4-Helixbündel-Bereich dient dazu, die Richtung, in die der Hebelarms wirkt, um 180 Grad zu drehen. Dabei ist die Translationsbewegung des Hebelarm-Endes abhängig vom Drehwinkel und der Richtung in die das Hebelarm-Ende relativ zur Drehachse zeigt (s. Abbildung 2).
Mit diesem „Motorkonstrukt“ ist es den Wissenschaftlern gelungen, die molekulare Grundlagen aufzuklären, warum sich Myosin stets in eine spezifische Richtung bewegt, und die so genannte „Hebelarm-Hypothese“ zu bestätigen, mit der man die Arbeitsweise von Myosin theoretisch zu erklären versucht. Die Forscher stützen mit ihrem künstlichen Motor ein Modell, wonach sich die Motordomänen von Myosinen und Kinesinen inhärent immer zum (+)-Ende der Filamente bewegen. Die Umkehr der Bewegungsrichtung, die man auch in natürlich vorkommenden Mitgliedern beider Motorproteinfamilien beobachten kann, haben die Forscher durch den gezielten Einbau einer geeigneten Domäne in den Nackenbereich des künstlich montierten Motorproteins erreicht.
Das rationale Design eines biologischen Motorproteins mit einer gewünschten Funktion – hier der „umgekehrten“ Laufrichtung – ist ein wichtiger Erfolg auf dem Weg, Proteine mit maßgeschneiderten Eigenschaften zu bauen. „Unsere Arbeit zeigt deutlich, wie weit man heute schon beim Protein-Design gekommen ist“, sagt Prof. Dietmar Manstein, Lehrstuhlinhaber an der MHH und zuvor Arbeitsgruppenleiter am Max-Planck-Institut für medizinische Forschung. „Das war kein Trial-and-Error, sondern wir haben gezielt geeignete Komponenten ausgewählt und verknüpft, um ein neues Protein mit den gewünschten Eigenschaften herzustellen.“ Der maßgeschneiderte Bau molekularer Motoren, deren Geschwindigkeit, Stärke und Richtung man einstellen kann, ermöglicht vielfältige Anwendungen, die von der Nanotechnologie bis zur molekularen Medizin reichen. Beispielsweise lassen sich die dielektrischen Eigenschaften von Chipoberflächen dynamisch verändern und einstellen, wenn man Methoden der molekularen Lithographie mit der Selbstorganisation geordneter Nanostrukturen aus Motorproteinen verbindet.
Das Projekt wurde unterstützt von der Max-Planck-Gesellschaft sowie der Deutschen Forschungsgemeinschaft im Rahmen des Schwerpunktprogramms „Molekulare Motoren“.
Weitere Informationen erhalten Sie von:
Prof. Dietmar J. Manstein
Institut für Biophysikalische Chemie
Medizinische Hochschule Hannover
Tel.: 0511 532-3700, Fax: -5966
E-Mail: manstein@bpc.mh-hannover.de
Media Contact
Weitere Informationen:
http://www.bpc.mh-hannover.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















