Analyse und Sortierung fluoreszierender Zell- und Teilchenpopulationen en miniature
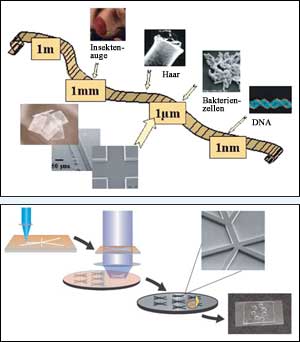
Abb.1: Biologische Strukturen wie z.B. Bakterienzellen haben Größendimensionen im Mikrometerbereich. Künstliche Strukturierungen im gleichen Größenmaßstab lassen sich nicht durch direkte mechanische Materialbearbeitung mit „makroskopischen" Werkzeug erzeugen. Stattdessen werden Techniken herangezogen, die zur Fabrikation elektronischer Chips seit langem standardmäßig eingesetzt und unter dem Begriff „Mikrosystemtechnik" (MST, auch: MEMS, Microelectromechanical Systems) zusammengefasst werden. <br> <br>Abb.2: Der Kernschritt zur Verkleinerung ist die optische Lithographie: Zunächst wird das gewünschte Design der Strukturen mit einem fokussierten Lichtstrahl auf eine Lithographie-Maske übertragen. Das Muster wird nun mittels UV-Licht verkleinert auf einen Siliziumwafer projiziert, der mit einem Photolack überschichtet ist. Nach Entwicklung des Photolacks wird der Siliziumwafer bis zur gewünschte Strukturierungstiefe geätzt. Der Siliziumwafer wird als Abgussform verwendet, d.h. die Kanäle sind als Negativ (hochstehend) auf dem Wafer enthalten. Der Mikrochip wird durch Abguss und Aushärtung einer Silicon-Mischung (PDMS) erhalten und mit einem Glasplättchen verschlossen. Mit dieser Methode lassen sich die PDMS-Chips sehr schnell und nach Bedarf im Labor ohne besondere Voraussetzungen (wie z.B. einem Reinraum oder Spezialmaschinen) vervielfältigen.
In Kombination mit konfokaler Fluoreszenzspektroskopie, bei der extrem kleine Detektionsvolumina erzeugt werden, können einzelne durchfließende fluoreszierende Teilchen beobachtet und analysiert, sowie mittels Fluoreszenz-Korrelations-Spektroskopie die Flussgeschwindigkeiten bestimmt und der Fluss kontrolliert werden.
Strukturierungen können sowohl auf der Oberfläche eines Chips untergebracht sein, aber auch in Form dreidimensionaler, definierter Kanalsysteme. Daraus hat sich seit Anfang der 1990er Jahre mit der Mikrofluidik – und mittlerweile auch der Nanofluidik – ein ganzes Forschungsgebiet entwickelt mit der Zielsetzung, die Besonderheiten von Flusssystemen in extrem kleinen Kanälen zu verstehen und zu nutzen.
Den Trend zur Miniaturisierung mit dem Ziel, Reaktionen und Analysen on-chip zu realisieren, wird vor allem auch durch wirtschaftliche Aspekte vorangetrieben, da die Durchführung von Reaktionen in Mikrofluidik-Kanälen viele Vorteile verspricht: Durch Parallelisierung und automatisierte Kontrolle von Reaktionsabläufen, ebenso aufgrund hoher Durchsatzraten bzw. geringer Transportzeiten können Reaktionen/Analysen schnell und Ressourcen schonend durchgeführt werden, z.B. sinkt der benötigte Probenverbrauch bis in den Nanoliterbereich (10-9L!). Desweiteren ist eine kontrollierbare und effiziente Reaktionsdurchführung möglich, insbesondere durch gezielte und schnelle Wärmezuführung bzw. –ableitung. Da sie mittels photolithographischer Prozesse (s. Abb.2) preisgünstig in hohen Stückzahlen hergestellt werden können, eignen sich Mikrofluidik-Chips insbesondere auch für die Einmalverwendung in der medizinischen Diagnostik.
Beim „Herunterskalieren“ der Kanaldimensionen treten dabei Phänomene auf, die auf makroskopischer Ebene eine untergeordnete Rolle spielen: Aufgrund des großen Verhältnis von Oberfläche zu Volumen ist die Beschaffenheit der Kanalwände von zentraler Bedeutung, z.B. um Adsorption von Probenlösung zu verhindern, ebenfalls werden Kapillarkräfte wirksam. Ein sehr charakteristisches Merkmal ist in Kanälen in Mikrometerdimensionen, in denen Flussgeschwindigkeiten von typischerweise wenigen bis etwa 100 mm/s erreicht werden, der laminare Fluss, d.h. es treten keine Turbulenzen auf. Dieses hat direkte Konsequenzen auf die Durchmischung verschiedener Substanzen zur Durchführung von Reaktionen, die ausschließlich aufgrund von Diffusion erfolgt und damit umso schneller ist, je kleiner die reagierenden Teilchen und je kleiner die Kanaldimensionen sind. Andererseits lässt sich der laminare Fluss auch nutzen, wie z.B. für die in Abb. 4 gezeigte Fokussierung der Probenlösung: Die durch den mittleren Kanal fließenden Partikel werden am Verzweigungspunkt durch die Pufferlösung, die von den seitlichen Kanälen zufließt, zu einer dünnen Flussschicht verengt, die über eine weite Distanz stabil fokussiert bleibt.
Durch die Anpassung der Größe des Reaktionsraumes an die Größe der Messsubstanzen ist die Möglichkeit gegeben, auch kleinste Partikel aufzuspüren und zu analysieren. Zumeist werden dazu optische Methoden, insbesondere die Fluoreszenzspektroskopie, eingesetzt, die weitgehend zerstörungsfrei und ohne mechanische Einwirkung auf die Probe erfolgen. Die Spezifität der Fluoreszenzspektroskopie wird durch gezielte Anregung fluoreszierender Moleküle erreicht, die intrinsisch in vielen biologischen Proben enthalten sind oder gezielt an Reaktionssubstanzen gekoppelt werden können. Die hohe Sensitivität wird im konfokalen Aufbau weiter verbessert (Abb. 3). Hierbei wird ein extrem kleines Detektionsvolumen von Bruchteilen von Femtolitern erzeugt – das entspricht der Größenordnung von Bakterienzellen – so dass in Kombination mit empfindlichen Detektoren der Nachweis fluoreszierender Einzelteilchen erfolgen kann. Die hohe räumliche Auflösung, verbunden mit einem geringen Hintergrundsignal, machen die konfokale Spektroskopie insbesondere für Messungen in miniaturisierten Kanälen besonders geeignet. Im Gegensatz zu Ensemblemessungen in Küvetten, in denen die gemittelten spektroskopischen Eigenschaften bestimmt werden, lassen sich individuelle Charakteristiken durchfließender Teilchen, z.B. Helligkeit, Farbe oder intramolekulare Wechselwirkungen verschiedener Fluorophore, evaluieren. Solche fluss-basierten Systeme eignen sich sowohl für die Analyse großer Probenvolumina mit vielen Einzelereignissen, z.B. große Zellpopulationen, als auch für extrem gering konzentrierte Proben. Verglichen mit „statischen Deckglasmessungen“ haben Messungen im Durchfluss weiterhin den Vorteil, dass auch große Mengen langsam diffundierender Probenteilchen in adäquater Zeit analysiert werden können, wobei bereits detektierte Teilchen nicht doppelt erfasst werden.
Eine statistische Erfassung vieler Einzelmoleküldurchtritte erfolgt durch die Korrelationsanalyse, in der die dynamischen Prozesse einzelner Moleküle in ihrer zeitlichen Entwicklung beschrieben werden, so dass Informationen über die Aufenthaltsdauer der Teilchen im Detektionsvolumen erhalten werden. Für gerichtete Bewegungen wie sie im Fall fließender Lösungen durch die Mikrofluidik-Kanäle vorliegen, lässt sich aus der Aufenthaltsdauer die Flussgeschwindigkeit der Teilchen bestimmen: ein wichtiger Parameter, der sowohl für analytische Versuche (z.B. kinetische Messungen), ebenso wie für die Kontrolle von Flusssystemen unerlässlich ist.
Im Vordergrund biochemischer und biologischer Applikationen stehen neben der Durchführung von Reaktionen (z.B. PCR-on-chip), der Beobachtung des Reaktionsverlaufes und der Analyse der Probenlösungen, insbesondere auch die Separierung von Reaktionsmischungen.
Viele Separationsstechniken, vor allem elektrophoretische und chromatographische Verfahren, in denen die Teilchen nach physikalischen Parametern wie Größe (bzw. Ladung) aufgetrennt werden – konnten mittlerweile erfolgreich auf Mikrochips realisiert werden, wobei die Auftrennungszeit verglichen mit makroskopischen Techniken deutlich reduziert ist. Sie werden z.B. zur Auftrennung und Größenbestimmung von DNA-Fragmenten eingesetzt.
Eine andere Strategie wird bei einem „aktiven“ Sortierungsverfahren verfolgt: Hierbei wird die Probe erst durch einen Detektionspunkt geleitet und danach – in Abhängigkeit des Analyseresultats – in verschiedene Ausgangskanäle gelenkt.
Die Realisierung dieser Sortierungsstrategie macht eine schnell und punktuell steuerbare Kontrolle des Flusses im Kanal erforderlich. Ein Beispiel für einen Mikrosortierer, in dem Mischungen fluoreszierender Teilchen und Zellen nach Farbe oder Fluoreszenzintensität in zwei unterschiedliche Auffangreservoirs aufgeteilt werden können, ist in Abb. 4 gezeigt. Die Funktion dieses Mikrochips entspricht einem kommerziellen FACS-Gerät (fluorescence activated cell sorter), in dem große Zellpopulationen nach spektroskopischen Eigenschaften gezählt und sortiert werden können. Der µFACS-Chip ermöglicht aber durch spezielle Kanalgeometrien, modular mehrere Reaktions-und Analyseschritte unmittelbar hintereinander durchzuführen, also z.B. die sortierte Probe direkt für den nächsten Reaktionsschritt einzusetzen. In dem gezeigten Beispiel kann eine solche on-chip-Reaktion noch vor dem Sortierungsschritt erfolgen: Fügt man in die seitlichen Kanäle der Fokussierungseinheit an Stelle der Pufferlösung eine reaktive Substanz dazu, wird die Reaktion beim Zusammenfluss initiiert. Eine solche Reaktion kann z.B. die Bindung Farbstoff-markierter Substanzen an die Oberfläche einer Zellmembran sein. Im Mikrosortierer können nun die Zellen, die bis zum Detektionspunkt eine Oberflächenreaktion eingegangen sind, von solchen Zellen abgetrennt werden, bei denen keine Reaktion stattfindet, und auf diese Weise spezifische Wechselwirkungen wie Rezeptor-Ligand-Erkennung von unspezifischen unterschieden werden.
Die Kombination der hochsensitiven Messmethode mit extremer Miniaturisierung des Probenraumes eröffnet neben zellbiologischen Applikationen viele neue Perspektiven, Einzelteilchen zu analysieren und manipulieren. Ein weiter führender Ansatz ist die Analyse/Sortierung verschiedener Moleküle bezüglich ihrer intermolekularen Wechselwirkung. Umdabei Reaktionen auf molekularer Ebene differenzieren zu können, ist die Notwendigkeit gegeben, alle beteiligten Molekülspezies räumlich zu isolieren. Eine solche Kompartimentierung des Reaktionsraumes kann z.B. durch Bildung von Emulsionen erfolgen, in denen Wassertröpfchen mit der Reaktionsmischung in einer Ölphase eingeschlossen werden, oder durch Bildung von Vesikeln, in denen das Reaktions-gemisch durch eine dünne Doppelschicht aus dipolaren Lipiden eingeschlossen ist. Auf diese Weise lässt sich in Zunkunft vielleicht sogar eine aktive Sortierung einzelner Biomoleküle in der flüssigen Phase ermöglichen.
Media Contact
Weitere Informationen:
http://www.mpibpc.gwdg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Diamantstaub leuchtet hell in Magnetresonanztomographie
Mögliche Alternative zum weit verbreiteten Kontrastmittel Gadolinium. Eine unerwartete Entdeckung machte eine Wissenschaftlerin des Max-Planck-Instituts für Intelligente Systeme in Stuttgart: Nanometerkleine Diamantpartikel, die eigentlich für einen ganz anderen Zweck bestimmt…

Neue Spule für 7-Tesla MRT | Kopf und Hals gleichzeitig darstellen
Die Magnetresonanztomographie (MRT) ermöglicht detaillierte Einblicke in den Körper. Vor allem die Ultrahochfeld-Bildgebung mit Magnetfeldstärken von 7 Tesla und höher macht feinste anatomische Strukturen und funktionelle Prozesse sichtbar. Doch alleine…

Hybrid-Energiespeichersystem für moderne Energienetze
Projekt HyFlow: Leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem für moderne Energienetze. In drei Jahren Forschungsarbeit hat das Konsortium des EU-Projekts HyFlow ein extrem leistungsfähiges, nachhaltiges und kostengünstiges Hybrid-Energiespeichersystem entwickelt, das einen…





















