Eine Anstandsdame für den ‘Wächter des Genoms’
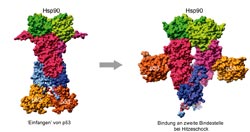
Strukturbild des Komplexes aus Hsp90. Jede Untereinheit ist dimer (jeweils in dunklerer<br>und hellerer Tönung angezeigt). Die Domänen des Hsp90 sind in grün (N-terminale Domäne),<br>dunkelrot (Mitteldomäne) und blau (C-terminale Domäne) und die von p53 in orange gezeigt. p53<br>bindet sowohl an die C-terminale Domäne (linkes Bild) als auch schwächer an die Mitteldomäne<br>(rechts) von Hsp90.<br>
Das Protein p53 spielt eine essentielle Rolle in der Krebsentstehung. Es verhindert, dass aus einer gesunden Zelle eine Krebszelle wird, indem es bei Schädigungen des Erbguts den kontrollierten Zelltod einleitet.
Das Hitzeschockprotein Hsp90 wiederum aktiviert und stabilisiertp53. Nun haben Wissenschaftler der Technischen Universität München (TUM) aufgeklärt, wo und mit welchen Mechanismen die beiden Proteine interagieren. Über ihre Ergebnisse berichten sie in der aktuellen Ausgabe der Zeitschrift Nature Structural and Molecular Biology.
In jeder Zelle gibt es Tausende von Proteinen, deren Aktivität und Lebensdauer reguliert werden müssen, um den Lebenszyklus der Zelle von der Zellteilung bis zum Zelltod zu steuern. Das Hitzeschockprotein Hsp90 spielt hierbei eine zentrale Rolle. Es ist ein sogenanntes „Chaperon“, eine Art „Anstandsdame“ oder „Qualitätskontrolleur“. Es prüft und steuert die Qualität und Aktivität einer Vielzahl wichtiger Signalproteine und hilft ihnen, die richtige Gestalt anzunehmen. Wenn die Zelle durch Hitze oder Sauerstoffmangel hohem Stress ausgesetzt ist, wird es vermehrt hergestellt, um eine Schädigung der Partnerproteine zu verhindern.
Eines der wichtigsten Partnerproteine von Hsp90 ist das Tumorsuppressor-Protein p53. Es verhindert an mehreren Stellen der Zelle die Krebsentstehung und wird daher auch als „Wächter des Genoms“ bezeichnet. Bei DNA Schäden sorgt p53 dafür, dass die Zelle sich nicht mehr teilt und aktiviert Reparaturmechanismen. Reichern sich zu viele Erbgutschäden an, leitet das Protein den kontrollierten „Selbstmord“ der Zelle ein. Ist p53 inaktiv, teilt die Zelle sich trotz Schäden weiter – ein Tumor entsteht. Bei mehr als der Hälfte aller Tumore ist das p53 Protein geschädigt oder inaktiviert, kann also die Kontrollfunktion nicht mehr ausüben.
Hsp90 wiederum bindet an p53 und hält es in einem funktionalen Zustand bis es seine eigentliche Funktion, nämlich die Bindung an bestimmte Elemente der DNA, erfüllen kann. Wie und wo die Bindung von p53 an Hsp90 dabei genau erfolgt, war bisher jedoch unklar und strukturell nicht charakterisiert.
Am Department Chemie der TU München gelang es nun einem Team von Biochemikern um Professor Horst Kessler, in Kooperation mit der Gruppe von Professor Johannes Buchner, Inhaber des Lehrstuhls für Biotechnologie, dieDetails der Bindung von p53 an Hsp90 aufzuklären. Horst Kessler war von 1989 bis 2008 Inhaber des Lehrstuhls für Organische Chemie und Biochemie der TUMünchen, und ist seit Oktober 2008 Carl-von-Linde-Professor am Institute for Advanced Study der TU München (TUM-IAS).
Mit Hilfe der kernmagnetischen Resonanzspektroskopie (NMR) konnten die Wissenschaftler am Bayerischen NMR-Zentrum in Garching zum ersten Mal die Interaktionsflächen zwischen Hsp90 und p53 charakterisieren und zeigen, dass p53 in einer bereits strukturierten Form an Hsp90 bindet. Dadurch wird p53 in einem funktionalen Zustand gehalten bis diese Interaktion durch seinen eigentlichen Bindungspartner DNA aufgelöst wird. Um p53 im richtigen Zustand zu halten, müssen dabei mehrere Interaktionsflächen an verschiedenen Stellen des Hsp90 Proteins in fein abgestimmter Weise zusammen wirken.
Bei der kernmagnetischen Resonanzspektroskopie wird eineProbe aus gelösten Proteinen in ein extrem starkes homogenes Magnetfeld gebracht und mit komplizierten Folgen von Radiofrequenzimpulsen bestrahlt. Die Atomkerne im Protein reagieren darauf mit einer charakteristischen Antwortfrequenz, die von der Umgebung des jeweiligen Kerns abhängt und von den Wissenschaftlerngemessen werden kann. „Jeder einzelne angeregte Kern zeigt dabei eine eigene Frequenz“, erklärt Kessler. „Auf diese Weise können wir feststellen in welcher Beziehung die einzelnen Kerne zueinander stehen und so auf die Struktur desProteins schließen.“ Bindet p53 an Hsp90 ändern sich die Antwortfrequenzen an bestimmten Stellen des Proteins. An Hand dieser Änderungen können die Wissenschaftler sehen, an welche Stellen von Hsp90 das p53 Protein bindet.
Die neuen Erkenntnisse über die Interaktionsflächen zwischen Hsp90 und p53 haben eine große Bedeutung für die Entwicklung neuer Krebsmedikamente. Denn Hsp90 stabilisiert nicht nur intaktes p53 sondern vor allem auch mutierte Versionen des Proteins. Dies führt zu einer negativen Wirkung des Chaperons. Der Grund: Das durch Hsp90 aufrecht erhaltene defekte p53 bindet seinerseits an aktives p53 und inaktiviert es – ein Tumor kann entstehen. Medikamente, die an den gefundenen Stellen angreifen, könnten in Zukunft verhindern, dass Hsp90 an defektes p53 in Krebszellen binden undstabilisieren kann. „Viele der in Tumoren veränderten p53 Varianten sind weniger stabil als intaktes p53 und benötigen daher Hsp90 umso mehr“, erklärt Franz Hagn, Erstautor der Studie. „Hemmt man diese Interaktion, wird vor allem das mutierte p53 entsorgt. Dadurch kann das intakte p53 seine Funktion nocherfüllen, geschädigte Zellen beseitigen und den Krebs verhindern.“
In ihrer Studie stellten Kessler, Buchner und ihr Team fest, dass p53 nicht nur wie bislang vermutet an die mittlere Domäne von Hsp90, sondern ebenfalls mit hoher Affinität an einen Bereich der C-terminalen Domäne des Proteins bindet. Verantwortlich für die Stabilität dieser Bindung sind dabei an beiden Bindungsstellen von Hsp90 negativ geladene Aminosäuren. „Diese Stellen ähneln der DNA, deren Phosphatrückrat ebenfalls negativ geladen ist“, erklärt Kessler. „Hsp90 ahmt also den eigentlichen Partner von p53 nach. So wird der Komplex aus beiden Proteinen zusammen gehalten.“ Dabei bleibt p53 in seinem Ursprungszustand erhalten und kann weiterhin an DNA binden.
Die Arbeitwurde unterstützt durch das TUM Institute for Advanced Study, die DeutscheForschungsgemeinschaft (SFB 594), den Exzellenzcluster Center for Integrated Protein Science Munich (CIPSM), das Elitenetzwerk Bayern, den Fonds der Chemischen Industrie sowie der European Molecular Biology Organization.
Originalpublikation:
Structural analysis of the interaction between Hsp90 and the tumor suppressor protein p53
Franz Hagn, Stephan Lagleder, Marco Retzlaff, Julia Rohrberg, Oliver Demmer, Klaus Richter, Johannes Buchner and Horst Kessler
Nature Structural & Molecular Biology, DOI: 10.1038/nsmb.2114
Kontakt:
Prof. Dr. Horst Kessler
Institute for Advanced Study und
Department Chemie
Technische Universität München
Lichtenbergstraße 4, 85748 Garching, Germany
Tel.: +49 89 289 13300
Fax: +49 89 289 13210
E-Mail: Horst.Kessler@tum.de
Prof. Dr. Johannes Buchner
Department Chemie
Technische Universität München
Lichtenbergstraße 4
D-85748 Garching
Tel.: +49 89 289 13341
Fax: +49 89 289 13345
E-Mail: Johannes.Buchner@tum.de
Media Contact
Weitere Informationen:
http://www.org.chemie.tu-muenchen.de/ http://www.chemie.tu-muenchen.de/biotech/index.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















