Wie sich die Zelle bei der Zellkernteilung umformt
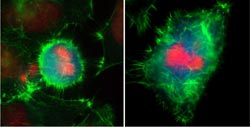
Immunfluoreszenzmarkierung einer Zelle in der frühen Mitose mit normaler (rechts) und erhöhter Eps8-Menge (links). In grün ist das Aktinzytoskelett, in rot DNA und in blau ein spezifischer Mitosemarker dargestellt.<br><br>Bildnachweis: Dr. Achim Werner<br>
Neue Erkenntnisse zum Prozess der Zellkernteilung in Säugerzellen haben Wissenschaftler des Zentrums für Molekulare Biologie der Universität Heidelberg gewonnen.
Die Forscher unter Leitung von Prof. Dr. Frauke Melchior konnten gemeinsam mit Kollegen aus Göttingen, Mailand und Memphis einen bislang unbekannten Mechanismus entschlüsseln, der bei der Umformung der Zelle während der Mitose eine wichtige Rolle spielt. Untersucht wurde der zeitlich begrenzte Abbau eines Proteins, das bestimmte Strukturen des mechanischen Aufbaus der Zelle, dem Aktinzytoskelett, reguliert. Die Forschungsergebnisse zu diesem Aktin-Regulator wurden in der Fachzeitschrift „Nature Cell Biology“ veröffentlicht.
Die gleichmäßige Verteilung von Chromosomen auf zwei Tochterzellen in der Mitosephase des Zellzyklus ist ein vielstufiger und exakt kontrollierter Prozess: Nach der Auflösung des Zellkerns und dem Aufbau der mitotischen Spindel folgen das Auseinanderziehen der Chromosomen in Richtung der Spindelpole, die Bildung von zwei Zellkernen und die Teilung der Zelle in zwei Tochterzellen. Nach den Worten von Prof. Melchior ist seit langem bekannt, dass das Aktinzytoskelett der Zelle – dies sind aus dem Strukturprotein Aktin bestehende fadenförmige Zellstrukturen – ebenfalls ein wichtiger, regulierender Teil dieses Prozesses ist.
Durch dynamische Veränderungen vor, während und nach der Mitosephase schafft es mechanische Voraussetzungen dafür, dass die Chromosomen symmetrisch aufgeteilt und damit die Erbinformationen gleich auf beide neugebildeten Tochterzellen verteilt werden. „Warum und wie sich das Aktinnetzwerk der Zelle besonders in den frühen Stadien der Mitose ändert, ist bis heute allerdings kaum verstanden. Dazu gehört insbesondere auch die Frage, wie sich Zellen mit dem Eintritt in Zellteilung abrunden und mit dem Austritt aus der Zellteilung wieder abflachen“, erläutert Dr. Achim Werner, der in der Gruppe von Prof. Melchior maßgeblich an den Forschungsarbeiten beteiligt war.
Die Heidelberger Wissenschaftler konnten jetzt zeigen, dass der zeitlich begrenzte Abbau eines Aktin-Regulators im Zytoskelett der Zelle – er trägt die Bezeichnung Eps8 – eine wichtige Rolle in der Mitosephase spielt. Die Degradation von Eps8, das ein nur scheinbar „stabiles“ Protein ist, wird dabei durch eine bislang wenig bekannte Ubiquitin-E3-Ligase vermittelt. „Schaltet man diesen Degradationsmechanismus aus, kommt es zu einer verzögerten Zellabrundung und einer Verlangsamung der frühen Phasen der Mitose. Ist aber zu wenig Eps8 während der späten Mitosephase vorhanden, treten dramatische Verformungen der Zellen auf“, erklärt Dr. Werner. Die genaue Kontrolle der Menge an Eps8 trägt damit zu den strukturellen Änderungen bei, die eukaryotische Zellen durchlaufen müssen, um ihre Erbinformationen korrekt auf zwei Tochterzellen zu verteilen. „Unsere Arbeiten zeigen einmal mehr, dass die kontrollierte Proteindegradation einen entscheidenden Anteil an der Steuerung zellulärer Prozesse hat“, erläutert Prof. Melchior.
Die Forschungsarbeiten waren Teil der DKFZ-ZMBH-Allianz, der strategischen Zusammenarbeit zwischen dem Deutschen Krebsforschungszentrum (DKFZ) und dem Zentrum für Molekulare Biologie der Universität Heidelberg (ZMBH). Mitgewirkt haben daran auch Forscher des Max-Planck-Instituts für biophysikalische Chemie in Göttingen und des Universitätsklinikums Göttingen, des FIRC Institute of Molecular Oncology (IFOM) in Mailand und der Universität Mailand sowie des Howard Hughes Medical Institute – St. Jude Children’s Research Hospital – in Memphis.
Originalveröffentlichung:
A. Werner, A. Disanza, N. Reifenberger, G. Habeck, J. Becker, M. Calabrese, H. Urlaub, H. Lorenz, B. Schulman, G. Scita & F. Melchior: SCF-Fbxw5 mediates transient degradation of actin remodeller Eps8 to allow proper mitotic progression, Nature Cell Biology (published online 13 January 2013), doi:10.1038/ncb2661
Kontakt:
Prof. Dr. Frauke Melchior
Zentrum für Molekulare Biologie der Universität Heidelberg
Telefon (06221) 54-6804
f.melchior@zmbh.uni-heidelberg.de
Kommunikation und Marketing
Pressestelle, Telefon (06221) 54-2311
presse@rektorat.uni-heidelberg.de
Media Contact
Weitere Informationen:
http://www.uni-heidelberg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neuartiges Material für nachhaltiges Bauen
Innovativer Werkstoff für eine energieeffiziente Architektur: Forschende des Karlsruher Instituts für Technologie (KIT) stellen in der aktuellen Ausgabe der Fachzeitschrift Nature Communications ein polymerbasiertes Material mit besonderen Eigenschaften vor. Das…

Neues Antibiotikum gegen Erreger der Flussblindheit und Lymphatischen Filariose
Prof. Achim Hoerauf, Direktor des Instituts für Medizinische Mikrobiologie, Immunologie und Parasitologie des Universitätsklinikums Bonn (UKB), und seinem Team ist es in Kollaboration mit der Abteilung Pharmazeutische Technologie und Biopharmazie…
Evolutionäre Genomik: Folgen biodiverser Fortpflanzungssysteme
Die Deutsche Forschungsgemeinschaft (DFG) fördert die Einrichtung eines neuen Graduiertenkollegs (GRK) in der Biologie an der Universität Göttingen. Das GRK mit dem Titel „Evolutionary Genomics: Consequences of Biodiverse Reproductive Systems…