Tiefseebakterien ernähren sich wie ihre Nachbarn
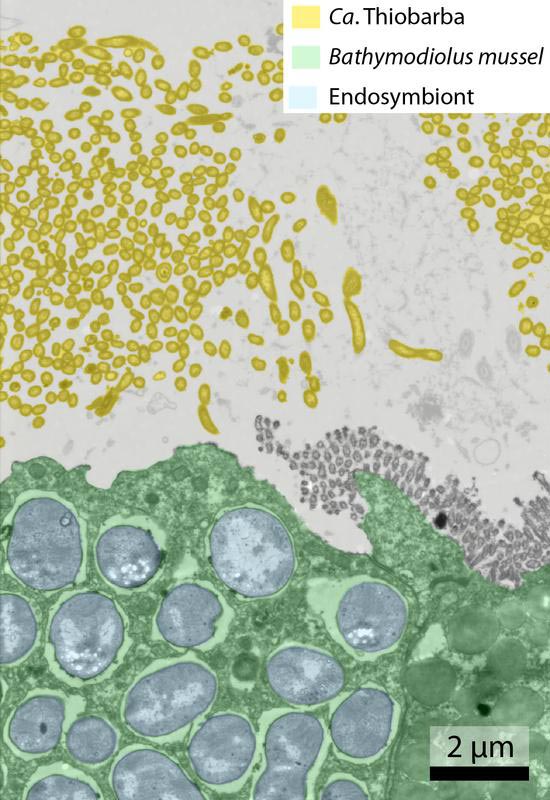
Eingefärbtes Bild aus dem Transmissionselektronenmikroskop; Bathymodiolus-Gewebe in Grün; Zellen von Ca. Thiobarba, die außerhalb der Wirtszellen leben, in Gelb. Max-Planck-Institut für Marine Mikrobiologie / Nikolaus Leisch
In der Tiefsee fernab des Sonnenlichts nutzen Organismen chemische Energie, um Kohlenstoff zu binden. An hydrothermalen Quellen – an denen heißes, mineralreiches Wasser aus hoch aufragenden Schloten, den sogenannten schwarzen Rauchern, sprudelt – lässt die chemische Energie im austretenden Wasser üppige Ökosysteme sprießen. In dieser scheinbar lebensfeindlichen Umgebung gedeihen Muscheln, die von symbiotischen Bakterien innerhalb ihrer Kiemen ernährt werden. Die Bakterien verwandeln Substanzen aus den Quellen, die die Muschel nicht selbst nutzen kann, in schmackhafte Nahrung für den Wirt. Eine Internationales Team von Forschenden um Nicole Dubilier vom Max-Planck-Institut für Marine Mikrobiologie in Bremen und Jillian Petersen, die mittlerweile an der Universität Wien tätig ist, berichtet nun im ISME Journal, dass die Kohlestofffixierung in der Tiefsee vielfältiger ist als bisher angenommen.
Thiobarba, das neueste Mitglied in der Symbiose
Dass Tiefseemuscheln der Gattung Bathymodiolus, entfernte Verwandte der im Flachwasser lebenden Miesmuschel, in ihren Kiemen Symbionten beheimaten, ist seit Langem bekannt. Im Jahr 2016 entdeckte Adrien Assié während seiner Doktorarbeit am Max-Planck-Institut für Marine Mikrobiologie, dass auch zwischen den Kiemen der Muschel symbiotische Bakterien leben, die er Thiobarba nannte. Assiés weitere Untersuchung zeigte, dass diese Bakterien nicht nur einer bisher unbekannten Familie angehören, sondern sich auch auf unerwartete Weise ernähren. „Thiobarba bindet Kohlenstoff mit Hilfe des Calvin-Zyklus”, erklärt Nikolaus Leisch, einer der beiden Erstautoren der Studie. „Sie sind die ersten aus dieser Bakteriengruppe, die diesen Weg der Kohlenstofffixierung nutzen.” Üblicherweise nutzt diese Gruppe den sogenannten umgekehrten TCA-Zyklus, der deutlich energieeffizienter ist, um Kohlenstoff zu fixieren. Allerdings funktioniert dieser nicht besonders gut, wenn Sauerstoff im Wasser ist – und das ist er in den Kiemen der Muschel reichlich. „Diese Entdeckung stellt unsere bisherigen Annahmen darüber, welche Bakteriengruppen welche Art der Kohlenstofffixierung verwenden, in Frage“, so Leisch weiter.
CO2 fixieren nach Art der Nachbarn
Die Familie Thiobarba gehört einer Bakteriengruppe namens Epsilonproteobacteria an, die kürzlich in Campylobacterota umbenannt wurden. Bisher waren keine Mitglieder dieser Gruppe bekannt, die mit Muscheln in Symbiose leben oder den Calvin-Zyklus nutzen. Woher hat Thiobarba die nötigen genetischen Werkzeuge für diesen Zyklus? „Unser Ergebnisse, basierend auf metagenomischer Sequenzierung, deuten darauf hin, dass sie einige der erforderlichen Gene von anderen Symbionten erworben haben, die in den Kiemen der Muscheln leben“, sagt Adrien Assié, der andere Erstautor der Studie, der mittlerweile am Baylor College of Medicine in Houston, Texas, tätig ist. „Da diese Endosymbionten innerhalb des Muschelgewebes leben, haben sie eine deutlich engere symbiotische Beziehung zur Muschel entwickelt. Bevor sich Thiobarba erfolgreich auf den Kiemen von Bathymodiolus ansiedeln konnte, müssen sich ihre Vorfahren das nötige Handwerkszeug von den Endosymbionten abgeschaut haben. Dadurch war es ihren Nachfahren möglich, den Muschelwirt so erfolgreich zu besiedeln.“
Symbiose als Blaupause für die Evolution
Als nächstes machten sich die WissenschaftlerInnen auf die Suche nach ähnlichen Prozessen bei freilebenden Campylobacterota. Und tatsächlich enthielten Bakterien aus Wasserproben, die an Hydrothermalquellen entnommen wurden, die entsprechenden Gene. Der Calvin-Zyklus könnte in dieser Gruppe also durchaus weiter verbreitet sein als bisher angenommen. „Unsere Forschung an symbiotischen Bakterien bringt immer wieder Erkenntnisse zutage, die auch für freilebende Bakterien bedeutsam sind. Indem wir Symbiosen studieren, können wir viel über das mikrobielle Leben im Allgemeinen und dessen Evolution lernen“, schließt Projektleiterin Nicole Dubilier.
Dr. Nikolaus Leisch
Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
Telefon: +49 421 2028-760
E-Mail: nleisch@mpi-bremen.de
Dr. Fanni Aspetsberger
Pressesprecherin
Max-Planck-Institut für Marine Mikrobiologie, Bremen, Deutschland
Telefon: +49 421 2028-947
E-Mail: faspetsb@mpi-bremen.de
Adrien Assié, Nikolaus Leisch, Dimitri V. Meier, Harald Gruber-Vodicka, Anke Meyerdierks, Manuel Kleiner, Tjorven Hinzke, Samantha Joye, Nicole Dubilier, Jillian M. Petersen: Horizontal acquisition of a patchwork Calvin cycle by symbiotic and free-living Campylobacterota (formerly Epsilonproteobacteria). ISME Journal. DOI: 10.1038/s41396-019-0508-7
Media Contact
Weitere Informationen:
https://www.mpi-bremen.de/Page4204.htmlAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















