Schaltmechanismus kontrolliert Schmerzempfinden
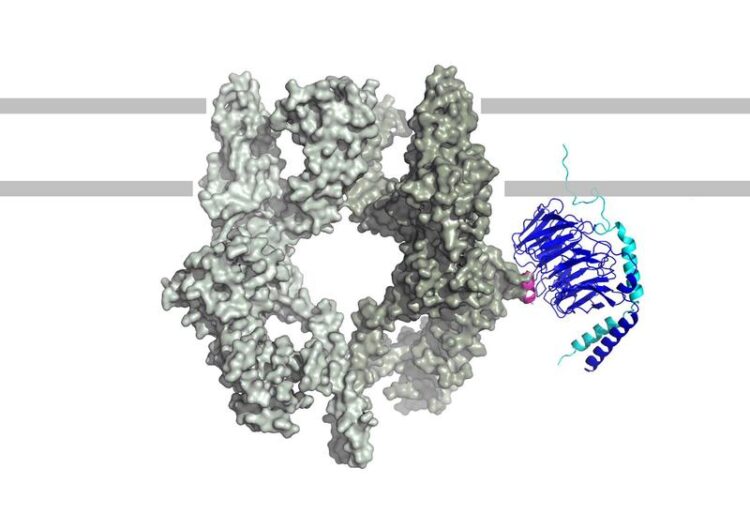
Wenn ein TRPM3-Kanal (links) und ein Gβγ-Protein (rechts) aneinander koppeln, führt dies zur Linderung von Schmerzen.
Abbildung: Johannes Oberwinkler
Schmerz einfach ausknipsen wie mit einem Lichtschalter – mit diesem Vergleich beschreibt eine internationale Forschungsgruppe die Wechselwirkung von Proteinen, die an der Schmerzempfindung beteiligt sind. Das Team um den Marburger Schmerzforscher Professor Dr. Johannes Oberwinkler berichtet in der Wissenschaftszeitschrift „PNAS“ über seine Ergebnisse.
Schmerzempfindliche Nervenzellen nehmen Reize auf, die auf Gefahren für den Körper hinweisen, etwa Hitze oder schädliche Substanzen. „Ionenkanäle vom TRPM3-Typ spielen eine wichtige Rolle für die Signaldetektion“, erklärt Johannes Oberwinkler vom Marburger Institut für Physiologie und Pathophysiologie, der die Forschungsarbeit leitete.
Stillt man Schmerzen durch Opium und opium-ähnliche Substanzen, so geschieht dies mittels so genannter Gβγ-Proteine – sie blockieren unter anderem die TRPM3-Kanäle der beteiligten Nervenzellen. „Wir haben im Detail untersucht, wie Gβγ-Proteine die TRPM3-Kanäle hemmen“, sagt Oberwinkler.
Das Team führte molekulargenetische Experimente durch und charakterisierte die beteiligten Moleküle mittels Röntgenkristallographie, um aufzuklären, wie die Hemmung der Ionenkanäle vor sich geht. Das Kanalprotein enthält demnach einen Abschnitt von zehn Aminosäuren, der als Koppelungsstelle für Gβγ-Proteine dient; koppelt Gβγ an diesen Abschnitt, so dämpft dies die Aktivität des Ionenkanals, was die Schmerzempfindung lindert.
In der Zelle kann das Kanalprotein indes in unterschiedlichen Versionen vorliegen, mit oder ohne den fraglichen Abschnitt – das kommt ganz darauf an, an welchen Stellen das Kanalprotein geschnitten und wieder zusammengefügt wird. Die Fachleute sprechen hier vom „alternativen Spleißen“. „Je nachdem, ob der fragliche Abschnitt in das Kanalprotein eingeschlossen wird oder nicht, lässt sich die hemmende Wirkung des Gβγ-Proteins an- und ausschalten“, führt Oberwinkler aus.
Ließe sich die Wechselwirkung zwischen Gβγ und TRPM3-Kanälen künftig gezielt beeinflussen, indem man geeignete Medikamente entwickelt, so könnte dies die Behandlung von Schmerzen verbessern. „Ob das überhaupt geht, müssten aber langwierige und aufwändige Forschungsarbeiten erst noch erweisen“, betont der Hochschullehrer.
Professor Dr. Johannes Oberwinkler leitet die Arbeitsgruppe Molekulare Physiologie am Fachbereich Medizin der Philipps-Universität. Er gehört außerdem dem mittelhessischen Forschungszentrum CMBB an. Neben Oberwinkler und seinem Team sind weitere Forscherinnen und Forscher aus Belgien und den USA an der Veröffentlichung beteiligt. Die Deutsche Forschungsgemeinschaft und zahlreiche weitere Förderorganisationen unterstützten die beteiligten Wissenschaftlerinnen und Wissenschaftler finanziell.
Originalveröffentlichung: Marc Behrendt, Fabian Gruss & al.:
The structural basis for an on–off switch controlling Gβγ-mediated inhibition of TRPM3 channels, PNAS 2020, DOI: www.pnas.org/cgi/doi/10.1073/pnas.2001177117
Weitere Informationen:
Ansprechpartner: Professor Dr. Johannes Oberwinkler,
Arbeitsgruppe Molekulare Physiologie
Tel.: 06421 28-65427
E-Mail: johannes.oberwinkler@uni-marburg.de
Pressemitteilung von 2017 zur Schmerzforschung der Arbeitsgruppe: https://idw-online.de/de/news680391
Media Contact
Alle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…