10-fach schnellere Superauflösungsmikroskopie
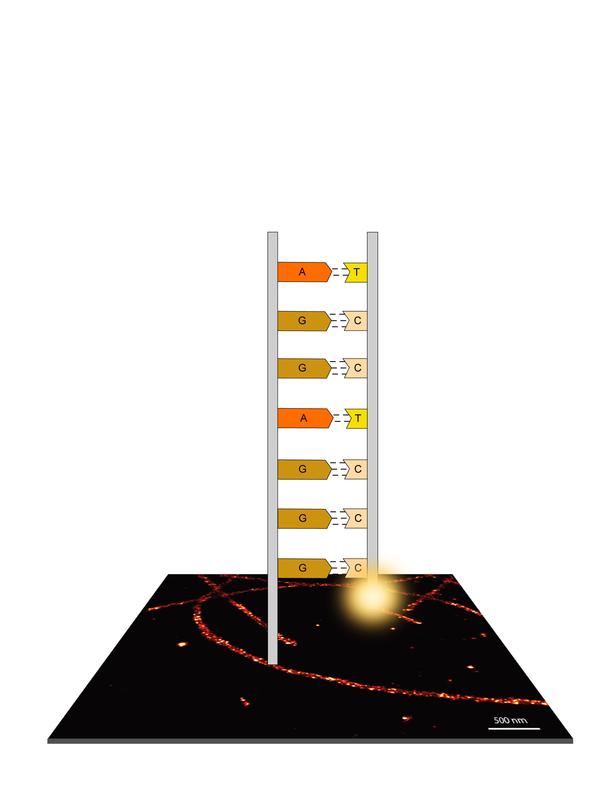
Darstellung des optimierten Farbstranges. Durch die neu konzipierte Abfolge der Basenpaare kann die Bindefrequenz erhöht werden und Bilder schneller aufgenommen werden. Illustration: Susanne Vondenbusch © MPI für Biochemie
Fortschritte in der Fluoreszenzmikroskopie ermöglichen es, biologische Prozesse unterhalb der klassischen Beugungsgrenze des Lichtes sichtbar zu machen. Eine Variante dieser sogenannten Superauflösungstechniken ist DNA-PAINT, die von Ralf Jungmann, Forschungsgruppenleiter für „Molekulare Bildgebung und Bionanotechnologie“ am Max-Planck-Institut für Biochemie und Professor für Experimentalphysik an der LMU, und Kollegen entwickelt wurde.
„DNA-PAINT ermöglicht es, superaufgelöste Bilder mit technisch vergleichsweise einfachen Mikroskopen zu erhalten“, sagt Jungmann. Um das zur Rekonstruktion superaufgelöster Bilder notwendige „Blinken“ von Zielmolekülen zu erreichen, werden diese bei DNA-PAINT mit kurzen DNA-Strängen markiert.
In Lösung befindet sich ein komplementärer, farbstoffmakrierter DNA-Strang, der wiederholt an den Zielstrang an- und abbindet und das Ziel zum „Blinken“ bringt. So erreicht DNA-PAINT sehr hohe Ortsauflösungen von besser als 10 nm und kann durch die Nutzung verschiedener DNA-Sequenzen, quasi Barcodes, viele Zielmoleküle gleichzeitig abbilden.
„In den letzten Jahren haben wir die Technik in vielen Bereichen verbessert. Eine große Einschränkung hat uns jedoch immer daran gehindert DNA-PAINT für biologisch relevante Hochdurchsatzstudien einzusetzen: Die vergleichsweise langsame Bildaufnahme“, sagt Jungmann. Klassische DNA-PAINT-Experimente nehmen üblicherweise mehrere zehn Minuten bis hin zu Stunden in Anspruch.
„Wir haben uns genau angeschaut, warum das so lange dauert“, so Florian Schüder, Erstautor der Studie und Mitarbeiter im Labor von Jungmann. „Durch optimiertes DNA-Sequenzdesign und verbesserte Pufferbedingungen konnten wir die Geschwindigkeit um einen Faktor 10 erhöhen“, so Schüder weiter.
Hierzu haben die Forscher in Kollaboration mit der Abteilung von Petra Schwille den Einfluss der DNA-Sequenz und der Basenabfolge auf die Geschwindigkeit der Hybridisierung, also das Ausbilden der Doppelhelix, untersucht. Der farbstoffmarkierte Einzelstrang, bei DNA-PAINT auch ‚Imager‘ genannt, besteht generell aus den Grundbausteinen der DNA, den vier Basen: Adenin (A), Thymin (T), Guanin (G) und Cytosin (C).
Der Einfluss der Basenkomposition und Länge der Einzelstränge auf die Bindezeit ist recht gut verstanden: Je länger der Doppelstrang und je mehr GC-Basenpaare in der Sequenz vorhanden sind, desto stabiler ist der DNA-Duplex und desto länger die Bindezeit.
Der Einfluss auf die Geschwindigkeit der Duplexbildung, und damit die Blinkgeschwindikgeit in DNA-PAINT, ist jedoch deutlich schlechter untersucht. Hier konnten die Forscher nun zeigen, dass die Ausbildung intramolekularer Haarnadelkonformationen, also das Falten mit sich selbst, in kurzen Strängen durch die Reduktion auf zwei Basen (z.B. nur T und C statt A, T, C, G) vollständig unterbunden werden kann.
„Wir haben jetzt die Stränge so entworfen, dass wir nur ein sogenanntes ‚Zweibuchstabenalphabet‘, z.B. nur T und C oder nur A und G, benutzen. So konnten wir die Bindefrequenz bereits um einen Faktor 5 steigern“, erklärt Schüder. „Durch weitere Optimierungen am verwendeten Puffersystem konnten wir zusätzlich einen Faktor 2 rausholen, so dass wir jetzt 10-mal schneller Bilder aufnehmen können“.
Von der DNA-Origami-Testplattform zur Zelle
Um die Verbesserungen der DNA-PAINT-Technik zu testen, kombinierten die Forscher diese mit DNA-Origami-Strukturen. Hierbei handelt es sich um selbstassemblierende DNA-Objekte in Nanometergröße, die sich autonom zu einer Art „Steckplatte“ falten. Auf dieser befinden sich die Gegenstränge, die als definierte Punkte im Abstand von ungefähr 5 nm aufgetragen sind.
Unter dem Mikroskop untersuchten die Forscher so die verbesserte Messgeschwindigkeit unter definierten Bedingungen. Im nächsten Schritt konnte die verbesserte Aufnahmegeschwindigkeit auch in zellulärer Umgebung gezeigt werden. Hierzu wurden in einer Zellprobe die Mikrotubli, ein Teil des Zytoskelettes, mit 10-fach höherer Geschwindigkeit sichtbar gemacht. „Wir konnten so ein quadratmillimetergroßes Areal in 8 Stunden bei einer Auflösung von 20 nm aufnehmen. Das hätte vorher fast vier Tage gedauert!“, erklärt Florian Schüder.
Ralf Jungmann fasst zusammen: „Mit der in dieser Studie gezeigten 10-fach höheren Abbildungsgeschwindigkeit eröffnen wir ein neues Kapitel superaufgelöster DNA-basierter Mikroskopie. Dies sollte es uns nun erlauben, DNA-PAINT für Hochdurchsatzstudien mit biologischer und biomedizinischer Relevanz z.B. in der Diagnostik einzusetzen.“
Prof. Dr. Ralf Jungmann
Molekulare Bildgebung und Bionanotechnologie
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
E-Mail: jungmann@biochem.mpg.de
F. Schüder, J. Stein, F. Stehr, A. Auer, B. Sperl, M.T. Strauss, P. Schwille und R. Jungmann: An order of magnitude faster DNA-PAINT imaging by optimized sequence design and buffer conditions. Nature Methods, Oktober 2019
https://doi.org/10.1038/s41592-019-0584-7
Media Contact
Alle Nachrichten aus der Kategorie: Medizintechnik
Kennzeichnend für die Entwicklung medizintechnischer Geräte, Produkte und technischer Verfahren ist ein hoher Forschungsaufwand innerhalb einer Vielzahl von medizinischen Fachrichtungen aus dem Bereich der Humanmedizin.
Der innovations-report bietet Ihnen interessante Berichte und Artikel, unter anderem zu den Teilbereichen: Bildgebende Verfahren, Zell- und Gewebetechnik, Optische Techniken in der Medizin, Implantate, Orthopädische Hilfen, Geräte für Kliniken und Praxen, Dialysegeräte, Röntgen- und Strahlentherapiegeräte, Endoskopie, Ultraschall, Chirurgische Technik, und zahnärztliche Materialien.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…