Zusatzantrieb für die Photosynthese
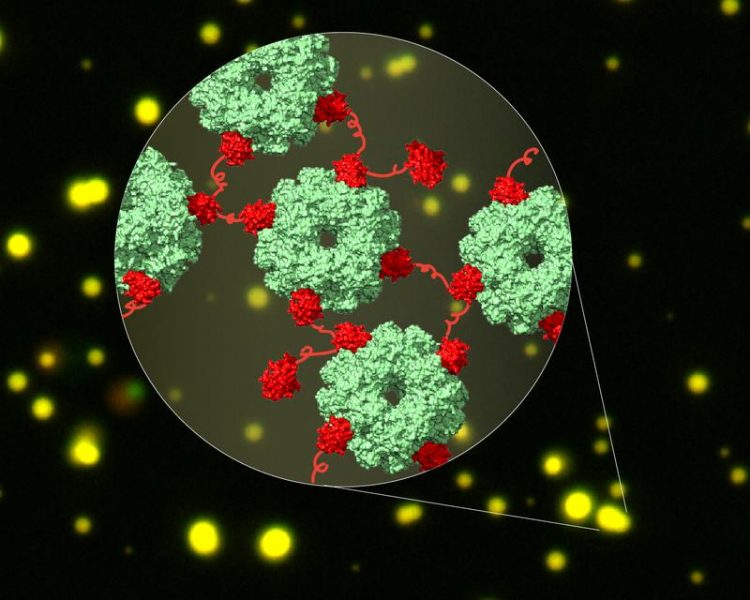
Kryo-EM Struktur des Komplex aus CcmM (rot) und Rubisco (grün) in flüssigen Tröpfchen (gelb). Die Ausbildung des Netzwerks ist der erste Schritt der Carboxysombiogenese in Cyanobakterien. Illustration: Huping Wang, Andreas Bracher © Max-Planck-Institut für Biochemie
Mit einem weltweiten Bevölkerungswachstum von schätzungsweise 80 Millionen Menschen jährlich nimmt auch die Nahrungsmittelnachfrage stetig zu. Um diesem Bedarf gerecht zu werden, arbeiten Wissenschaftler an Strategien mit denen sich die Produktivität von Nutzpflanzen steigern lässt.
Photosynthese – entscheidend, aber ineffizient
Während die meisten Organismen auf die Aufnahme von Nährstoffen angewiesen sind, um Energie für ihre Zellen zu erzeugen, können Pflanzen sowie einige Mikrobenarten ihre Zellen mit Lichtenergie versorgen.
In einem Prozess der als Photosynthese bezeichnet wird, wandeln sie dabei Wasser und Kohlenstoffdioxid (CO2) mit Hilfe von Sonnenlicht in Zucker und Sauerstoff um. Entscheidend für diese Reaktion ist das Enzym Rubisco, das für die Fixierung von CO2 aus der Atmosphäre verantwortlich ist.
Rubisco, das als das am häufigsten auf der Erde vorkommende Enzym gilt, arbeitet allerdings langsam und ineffektiv. Statt CO2 zu fixieren, kann Rubisco auch mit Sauerstoff reagieren.
Bei dieser Nebenreaktion geht viel Energie verloren. Deshalb versuchen Wissenschaftler, eine effizientere Version von Rubisco zu entwickeln, um das Pflanzenwachstum zu fördern.
Ein Team unter der Leitung von Manajit Hayer-Hartl, Leiterin der Forschungsgruppe „Chaperonin-vermittelte Proteinfaltung” am Max-Planck-Institut für Biochemie in Martinsried, hat jetzt einen wichtigen Beitrag zu diesen Bemühungen beigesteuert.
Cyanobakterien sind wasserlebende Mikroben, die Photosynthese betreiben. Sie haben dazu eine Strategie entwickelt, die die Effizienz ihres Rubisco-Enzyms steigert. Dazu erhöhen die Cyanobakterien die CO2-Konzentration in speziellen Strukturen, den sogenannten Carboxysomen, und beschränken ihr Rubisco auf diese Strukturen.
So reduzieren sie den Energieverlust, der durch die Nebenreaktion mit Sauerstoff entsteht. In der neuen Studie konnte jetzt gezeigt werden, wie die Bildung von Carboxysomen eingeleitet wird.
Rubisco einfangen für zusätzliche Energie
Cyanobakterien nutzen das Helferprotein CcmM, um Rubisco einzufangen. CcmM besteht aus mehreren sich wiederholenden Modulen, die der kleinen Untereinheit des Rubisco gleichen.
Deshalb vermutete man lange, dass diese Module bei einer Interaktion der Proteine die kleinen Rubisco-Untereinheiten ersetzen und dadurch Rubisco-Proteine miteinander verbinden. Der Komplex zwischen CcmM und Rubisco ist jedoch von einer hohen Dynamik geprägt und konnte deshalb nicht durch traditionelle Methoden der Strukturbiologie aufgeklärt werden.
„Wir haben in dieser Studie die Vorteile der sich rasant entwickelnden Kryo-Elektronenmikroskopie genutzt, um diese dynamischen Interaktionen zu erfassen”, erläutert Huping Wang, eine der Erstautoren der Studie. Mit Hilfe der Kryo-EM gelang den Forschern der Nachweis, dass CcmM nicht die kleine Untereinheit des Rubisco ersetzt, sondern Rubisco-Proteine über einen unerwarteten Mechanismus miteinander verknüpft.
Die Interaktion zwischen CcmM und Rubisco verursacht die Entmischung des Proteinkomplexes von anderen Proteinen in der Zelle.
„Diese Entmischung von Proteinen wird als Phasentrennung bezeichnet und ist ein Prozess, bei dem Proteine lokal konzentriert werden. In Cyanobakterien bildet sich dann die Proteinhülle des Carboxysoms rund um das phasengetrennte CcmM und Rubisco, um diese einzufangen“, beschreibt Xiao Yan, ebenfalls Erstautor der Studie. Ein ähnlicher Prozess der Phasentrennung von Proteinen ist auch an der Entstehung von neurodegenerativen Erkrankungen wie der amyotrophen Lateralsklerose beteiligt.
Die Carboxysom-Bildung fördert die Photosynthese, weil diese Mikrokompartimente den CO2-Gehalt im Umkreis von Rubisco erhöhen und das Enzym so effizienter arbeiten lassen. Die aktuellen Ergebnisse der Studie tragen enorm zur Verbesserung des Verständnisses bei, wie diese CO2-konzentrierenden Strukturen gebildet werden.
Manajit Hayer-Hartl beschreibt eine mögliche Anwendung der Studienergebnisse: „Wenn wir funktionierende Carboxysome auf höhere Pflanzen übertragen könnten, würde das die Nutzpflanzen zusätzlich anregen, CO2 noch effizienter zu fixieren. Dann würde die Energie, die normalerweise in der Reaktion von Rubisco mit Sauerstoff verloren geht, für die Erzeugung von Biomasse zur Verfügung stehen.“
Langfristig könnten die Forschungserkenntnisse von Hayer-Hartl dazu beitragen, effizientere Nutzpflanzen zu züchten, den Einsatz von Kunstdüngern zu reduzieren und die weltweite Nahrungsversorgung zu verbessern. [CW]
Über Manajit Hayer-Hartl
Dr. Manajit Hayer-Hartl promovierte 1984 in Chemie an der Universität Stirling, UK. Von 1984 bis 1990 forschte sie als Postdoktorandin am Louis-Pasteur-Institut in Straßburg, Frankreich, an der Ludwig-Maximilians-Universität in München und dem Jules Stein Eye Institut, Los Angeles, USA. Ihre Forschung führte sie von 1991 bis 1997 an das Sloan-Kettering-Institut, New York, USA. Anschließend war sie Projektgruppenleiterin am Max-Planck-Institut für Biochemie in Martinsried. Seit 2006 leitet sie hier die Forschungsgruppe „Chaperonin-vermittelte Proteinfaltung“. Sie untersucht grundlegende Funktionen molekularer Chaperone bei Proteinfaltung und Assemblierung. Hayer-Hartl ist gewähltes Mitglied der European Molecular Biology Organization (EMBO) und der deutschen Akademie der Wissenschaften (Leopoldina). Für ihre Forschung wurde sie unter anderem mit dem Dorothy Crowfoot Hodgkin Preis und dem Charles F. Kettering Preis ausgezeichnet.
Über das Max-Planck-Institut für Biochemie
Das Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München zählt zu den führenden internationalen Forschungseinrichtungen auf den Gebieten der Biochemie, Zell- und Strukturbiologie sowie der biomedizinischen Forschung und ist mit rund 35 wissenschaftlichen Abteilungen und Forschungsgruppen und ungefähr 800 Mitarbeitern eines der größten Institute der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. Das MPIB befindet sich auf dem Life-Science-Campus Martinsried in direkter Nachbarschaft zu dem Max-Planck-Institut für Neurobiologie, Instituten der Ludwig-Maximilians-Universität München und dem Innovations- und Gründerzentrum Biotechnologie (IZB). http://www.biochem.mpg.de
Dr. Manajit Hayer-Hartl
Chaperonin-vermittelte Proteinfaltung
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Deutschland
E-Mail: mhartl@biochem.mpg.de
http://www.biochem.mpg.de/hayer-hartl
Wang H*, Yan X*, Aigner H, Bracher A, Nguyen ND, Hee WY, Long BM, Price GD, Hartl FU, Hayer-Hartl M. Rubisco condensate formation by CcmM in β-carboxysome biogenesis. Nature, Januar 2019. (* trugen zu gleichen Teilen bei)
http://dx.doi.org/10.1038/s41586-019-0880-5
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















