Zellen steuern Energiestoffwechsel über Hedgehog-Signalweg
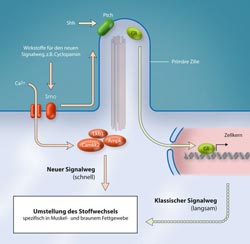
Die Bindung von Sonig Hedgehog (Shh) an seinen Rezeptor Patched (Ptch) aktiviert Smo. Im bislang bekannten klassischen Signalweg aktiviert Smo daraufhin den Gli-Transkriptionsfaktoren, die das Ablesen von Genen regulieren. Im neu entdeckten Signalweg löst die Aktivierung von Smo den Einstrom von Kalzium aus und führt zur Aktivierung verschiedener Kalzium-abhängiger Enzyme wie die Calmodulin-Kinase (Camkk2), AMP-aktivierte Kinase (Ampk) und Leberkinase B1 (Lkb1). Dieser Signalweg kann auch spezifisch von Wirkstoffen wie Cyclopamin aktiviert werden. Beide Signalwege verändern den Stoffwechsel von Muskel- und braunen Fettzellen und ermöglichen es ihnen, schnell große Mengen Glukose aufzunehmen und zu verwerten.<br><br>© Art For Science <br>
Krebs, Diabetes und Übergewicht haben eines gemeinsam: Sie verändern den zellulären Stoffwechsel. Wissenschaftler vom Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg und der Medizinischen Universität Wien haben zusammen mit einem internationalen Forscherteam einen neuen Signalweg für den Zellstoffwechsel aufgeklärt.
Demnach ermöglicht das Protein Hedgehog über einen bislang unbekannten Signalweg, dass Muskelzellen und braune Fettzellen unabhängig von Insulin Zucker aufnehmen können. Substanzen, die den Signalweg selektiv aktivieren, könnten demnach zur Behandlung von Übergewicht und Diabetes angewandt werden. Mit ihren Ergebnissen können die Forscher auch erklären, warum verschiedene neue Wirkstoffe gegen Krebs in klinischen Studien starke Nebenwirkungen ausgelöst haben.
Hedgehog war zunächst als wichtiges Protein für die Embryonalentwicklung unterschiedlichster Organismen identifiziert. Ohne Hedgehog geraten die Körperabschnitte des Embryos durcheinander. Hedgehog beeinflusst aber auch die Vermehrung, Wanderung und Spezialisierung von Zellen – also Vorgänge, die auch bei der Krebsentstehung eine Rolle spielen. Mutationen des Gens treten entsprechend bei verschiedenen Krebserkrankungen wie Bauchspeicheldrüsen-, Magen- oder Darmkrebs auf. Darüber hinaus blockiert Hedgehog die Bildung von „schlechtem“ weißem Fettgewebe. „Gutes“ braunes Fett, das zur Kontrolle der Körpertemperatur dient, ist davon nicht betroffen.
Hedgehog ist deshalb ein vielversprechendes Ziel für Medikamente gegen Krebs, Diabetes und Übergewicht. Die amerikanische Zulassungsbehörde FDA hat dieses Jahr den ersten Hemmstoff von Hedgehog, Vismodegib, als Krebsmedikament zugelassen. Gegenwärtig werden in klinischen Studien mindestens sechs weitere Wirkstoffe erprobt. Allerdings traten bei manchen der mit Vismodegib behandelten Patienten so starke Nebenwirkungen wie Gewichtsverlust und Muskelkrämpfe auf, dass über die Hälfte der Teilnehmer die Studien abbrechen mussten.
Die neuen Ergebnisse liefern nun eine Erklärung für die Muskelkrämpfe und zeigen, dass eine bereits bekannte, einfache und sichere Zusatzbehandlung die unerwünschten Wirkungen unterbinden kann. Die Forscher haben nämlich einen neuen, von der bisher bekannten Aktivierung von Transkriptionsfaktoren und Genen unabhängigen, Hedgehog-Signalweg entdeckt. Über diesen Weg steuern Zellen ihren primären Energiestoffwechsel, darunter den Glukose-, Fettsäure- und Aminosäurestoffwechsel.
Eine wichtige Rolle spielt dabei das Membranprotein Smo. Es steuert sowohl den bekannten Signalweg über Transkriptionsfaktoren als auch den neuen, schnelleren über das Enzym AMP-Kinase und Kalzium-Ionen. Smo wird aktiv, wenn Hedgehog an einen speziellen Rezeptor in der Zellmembran bindet. Im nun entdeckten Signalweg fließt Kalzium durch Membrankanäle in die Zelle und aktiviert Kalzium-abhängige Enzyme, die wiederum die AMP-Kinase aktivieren. Dies stellt den Stoffwechsel komplett um. Mit der AMP-Kinase und anderen Enzymen kann die Zelle schnell große Mengen Glukose aufnehmen und den Stoffaufbau und -abbau neu justieren. Anstelle möglichst effizient Energie in den Mitochondrien zu erzeugen, ermöglicht der Hedgehog-Signalweg zudem die Energiegewinnung über die Milchsäure-Vergärung – ein Prozess, mit dem beispielsweise Krebszellen ohne Sauerstoff ihre Energie gewinnen können (Warburg-Effekt).
Hedgehog-Hemmstoffe hungern auf diese Weise Krebszellen förmlich aus. Überraschenderweise stimulieren die klassischen Hedgehog-Hemmer sowohl den alten als auch den neuen Signalweg. Dieser Befund könnte bisherige Forschungsergebnisse in einem neuen Licht erscheinen lassen.
Die Aktivierung von Hedgehog und dem Smo-Kalzium-AMP-Kinase-Signalweg stört ab- und aufbauende Stoffwechselwege. „Eine aktive AMP-Kinase und verstärkter Stoffabbau könnte den Gewichtsverlust der Probanden in den klinischen Studien erklären. Insbesondere führt der Einstrom von Kalzium in Muskelzellen aber dazu, dass die Zellen kontrahieren und so Krämpfe auslösen“, erklärt Andrew Pospisilik vom Freiburger Max-Planck-Institut. Hedgehog-Hemmstoffe führen aber nicht zwangsläufig zu solchen Nebenwirkungen. „Wir haben die Wirkung verschiedener Substanzen auf Smo mit getestet und herausgefunden, dass es Hemmstoffe gibt, die die Kalzium- und Glukose-Werte nicht ansteigen lassen und keine Krämpfe hervorrufen. Die Entwicklung solcher Medikamente mit geringeren Nebenwirkungen ist also durchaus möglich“, sagt Pospisilik.
Außerdem entdeckten die Wissenschaftler, dass die Fettzellen deutlich mehr Glukose aufnehmen können – unabhängig von Insulin. Glukose-Toleranztests an Mäusen bestätigten den Befund. Dabei wird den Tieren eine festgelegte Menge Glukose über die Nahrung verabreicht und danach die Glukosekonzentration im Blut gemessen. Mäuse, die zuvor mit dem klassischen Hedgehog-Hemmer Cyclopamin behandelt wurden, hatten demnach weniger Glukose im Blut als unbehandelte Tiere. Offenbar erhöht Cyclopamin die Glukose-Aufnahme aber nur in braunem Fettgewebe und verschiedenen Muskelgewebe-Typen. So maßen die Forscher eine Erhöhung der Körpertemperatur um ein Grad – ein Zeichen verstärkter Aktivität von braunem Fettgewebe.
„Wirkstoffe, die nur den Smo-Kalzium-AMP-Kinase-Signalweg von Hedgehog aktivieren, sind also Kandidaten für Medikamente gegen Übergewicht sowie Typ-1- und Typ-2-Diabetes. Ähnlich wie die unselektiven Hedgehog-Hemmer besitzen sie das Potenzial, Muskelkrämpfe hervorzurufen. Dank unserer Ergebnisse wissen wir nun, dass ein neuer Wirkstoff zuerst an Muskelzellen getestet werden muss, bevor er an Menschen zum Einsatz kommt“, sagt Harald Esterbauer von der Medizinischen Universität Wien.
Ansprechpartner
J. Andrew Pospisilik
Max-Planck-Institut für Immunbiologie und Epigenetik, Freiburg
Telefon: +49 7615 108-757
Email: pospisilik@immunbio.mpg.de
Harald Esterbauer
Medizinische Universität Wien
Telefon: +43 14 0400-5359
Email: harald.esterbauer@meduniwien.ac.at
Originalpublikation
Raffaele Teperino, Sabine Amann, Martina Bayer, Sean L. McGee, Andrea Loipetzberger, Timothy Connor, Carsten Jaeger, Bernd Kammerer, Lilli Winter, Gerhard Wiche, Kevin Dalgaard, Madhan Selvaraj, Jeremy Reiter, Michael Gaster, Robert S. Lee-Young, Mark A. Febbraio, Claude Knauf, Patrice D. Cani, Fritz Aberger, Josef M. Penninger, J. Andrew Pospisilik und Harald Esterbauer
Hedgehog partial agonism drives Warburg-like metabolism in muscle and brown fat
Cell, 12. Oktober 2012
Media Contact
Weitere Informationen:
http://www.mpg.de/6386142/Hedgehog-SignalwegAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















