Wie die Gen-Kopiermaschine startet

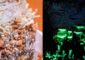
Die atomare Struktur des PIC. Die RNA-Polymerase II ist oben rechts in grau, der Transkriptionsfaktor TFIIH links in rosa zu sehen. Sandra Schilbach und Patrick Cramer / Max-Planck-Institut für biophysikalische Chemie
Lebende Zellen sind ständig in Aktion: Sie verwerten Nährstoffe, produzieren Werkzeuge, kommunizieren, wachsen, teilen oder bewegen sich. All diese Vorgänge muss die Zelle koordinieren und auf die Umgebung abstimmen. Damit das gelingt, unterliegen zentrale zelluläre Prozesse genauer Kontrolle. Ein solch hoch regulierter Prozess ist die Transkription.
Über sie kann die Zelle je nach Bedarf steuern, wann wieviel von welchem Protein hergestellt wird. Für diese Feinjustierung ist schon bei den Startvorbereitungen der Transkription eine große Zahl an Faktoren beteiligt. Ein jeder ist ein wichtiges Zahnrad in der Maschinerie und beeinflusst, wann die Polymerase mit der Abschrift eines Gens beginnen kann.
Wissenschaftler konnten in den vergangenen Jahren die räumlichen Strukturen der Pol II und vieler weiterer Proteine des Transkriptionsstarts ermitteln. Die Strukturen verraten, wie die Proteine funktionieren und miteinander arbeiten. Bislang fehlte allerdings der zusammenhängende Überblick: der dreidimensionale Aufbau des als PIC bezeichneten gesamten Komplexes aus Polymerase und den vielen weiteren Proteinen, die für den Transkriptionsstart entscheidend sind – eine für molekulare Maßstäbe gigantische Maschine.
Dem Forscherteam von Patrick Cramer, Leiter der Abteilung Molekularbiologie am MPI für biophysikalische Chemie, ist dieser Durchbruch gelungen. Die Göttinger Wissenschaftler konnten erstmals die Struktur des gesamten, 46 Proteine umfassenden PIC in atomarer Schärfe bestimmen und entscheidende Einzelheiten beim Transkriptionsstart klären. Von dieser Gesamtstruktur erhalten die Forscher nun Antworten darauf, wie der Start des Kopiervorgangs im Detail abläuft.
Ihren Erfolg verdanken die Max-Planck-Forscher sowohl ihrem Durchhaltevermögen – das Projekt läuft bereits seit 15 Jahren – als auch den jüngsten Fortschritten in der Kryo-Elektronenmikroskopie. „Mit dieser Technik lassen sich heute sehr große zelluläre Strukturen in ihrem atomaren Aufbau sichtbar machen“, erklärt Cramer, „allerdings meist nur, wenn es gelingt, diese Strukturen im Reagenzglas nachzubauen. “
So konnten die Wissenschaftler die dreidimensionale Struktur eines wichtigen Bestandteils des PIC rekonstruieren, den Transkriptionsfaktor TFIIH. TFIIH besteht selbst aus zehn Proteinen und hatte sich bislang als besonders harte Nuss für Strukturbiologen erwiesen, da sich der Komplex nicht nachbauen ließ. „Nach jahrelangen Optimierungen ist es uns schließlich gelungen, TFIIH gentechnisch herzustellen“, schildert Sandra Schilbach, Wissenschaftlerin im Team von Cramer und Erstautorin der jetzt in Nature erschienenen Arbeit.
Wie gelangt die RNA-Polymerase II an die genetische Information?
Die Struktur von TFIIH beantwortet eine für die Forschung entscheidende Frage: Wie öffnet die Zelle die DNA, damit Pol II an die genetische Information herankommt? „Die Transkription lässt sich mit der Kopie aus einem Buch vergleichen“, erläutert Schilbach. „Ein Buch muss man zunächst aufschlagen, um eine Seite kopieren zu können. So ist es auch bei den Genen.“ Allerdings liegen die Gene auf der DNA nicht gestapelt vor wie die Seiten eines Buches.
Stattdessen sind die beiden DNA-Stränge zu einer Doppelhelix gewunden. Man habe lange gerätselt, wie die DNA-Doppelhelix geöffnet werde, damit die Polymerase einen DNA-Strang kopieren kann, so Cramer. „Dank der neuen Struktur haben wir endlich eine genauere Vorstellung davon. Ein Motor-Protein in TFIIH nutzt Energie, um eine Spannung in der DNA zu erzeugen. Diese Spannung führt dazu, dass sich die eigentlich sehr stabile Doppelhelix öffnet.“
Für Cramer war die Aufklärung der PIC-Struktur immer das Ziel, seit es ihm im Jahr 2000 als jungem Wissenschaftler an der US-amerikanischen Stanford University gelungen war, die erste räumliche Struktur der Pol II zu ermitteln. „Das war damals ein großer Erfolg: Wir konnten erstmals detailliert verstehen, wie diese Nanomaschine arbeitet. Doch das erklärte noch nicht, wie die Zelle die Transkription steuert.“
Die neue Struktur beantworte nun viele der seither offenen Fragen. „Allerdings gibt es insbesondere bei der Regulation des Starts weiter ungeklärte Details“, so Cramer. Die möchte er sich jetzt mit seinen Mitarbeitern vornehmen. Die Wissenschaftler wollen in den nächsten Jahren unter anderem aufklären, wie die Transkription durch Wachstumssignale reguliert wird. (fk/cr)
Originalveröffentlichung:
Schilbach S, Hantsche M, Tegunov D, Dienemann C, Wigge C, Urlaub H, Cramer P: Structures of transcription pre-initiation complex with TFIIH and Mediator. Nature, doi: 10.1038/nature24282 (2017).
Kontakt:
Prof. Dr. Patrick Cramer, Abteilung Molekularbiologie
Max-Planck-Institut für biophysikalische Chemie
Tel.: +49 551 201-2800
E-Mail: patrick.cramer@mpibpc.mpg.de
Dr. Frederik Köpper, Presse- und Öffentlichkeitsarbeit
Max-Planck-Institut für biophysikalische Chemie
Tel.: +49 551 201-1310
E-Mail: frederik.koepper@mpibpc.mpg.de
http://www.mpibpc.mpg.de/15801321/pr_1721 – Original-Pressemitteilung vom Max-Planck-Institut für biophysikalische Chemie
http://www.mpibpc.mpg.de/de/cramer – Webseite der Abteilung Molekularbiologie, Max-Planck-Institut für biophysikalische Chemie
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…