Wichtiger Proteinproduzent entschlüsselt
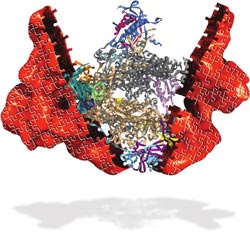
Mithilfe von Röntgenstrahlen konnte das Innenleben der RNA Polymerase I auf atomarem Niveau erstmals enthüllt werden.<br><br>Grafik: María Moreno-Morcillo<br>
Wissenschaftler unter Beteiligung der Universität Göttingen haben die dreidimensionale Struktur der RNA Polymerase I bestimmt und so eine wichtige Brücke zwischen der DNA und der Frage, wie unser Körper funktioniert, geschlossen.
Dazu musste das komplexe Molekül, das seinerseits aus 14 Proteinen zusammengesetzt ist, erst kristallisiert werden. Dadurch konnte mithilfe von Röntgenstrahlen das Innenleben der RNA Polymerase I auf atomarem Niveau enthüllt werden. Die Ergebnisse sind in der renommierten Fachzeitschrift Nature erschienen.
Die Doppelhelix der DNA ist bekannt als Träger unseres Erbguts. Auf molekularer Ebene müssen aus der DNA Proteine hergestellt werden, die die Arbeit in unserem Körper übernehmen: Enzyme verdauen im Magen, Insulin regelt unseren Blutzuckerspiegel. Verantwortlich für die Proteinproduktion in der Zelle ist das Ribosom. Das Bindeglied zwischen DNA und Ribosom ist die sogenannte „RNA Polymerase I“, die mithilfe der DNA den Großteil des Ribosoms herstellt.
Jetzt haben Wissenschaftler unter Beteiligung der Universität Göttingen die dreidimensionale Struktur der RNA Polymerase I bestimmt und so eine wichtige Brücke zwischen der DNA und der Frage, wie unser Körper funktioniert, geschlossen. Dazu musste das komplexe Molekül, das seinerseits aus 14 Proteinen zusammengesetzt ist, erst kristallisiert werden. Dadurch konnte mithilfe von Röntgenstrahlen das Innenleben der RNA Polymerase I auf atomarem Niveau enthüllt werden. Die Ergebnisse sind in der renommierten Fachzeitschrift Nature erschienen.
Als die Wissenschaftler bei der Berechnung der Struktur RNA Polymerase I nach fünf Jahren Forschung nicht weiter kamen, wurde durch die Beteiligung des Kristallographen Dr. Tim Grüne vom Institut für Anorganische Chemie der Universität Göttingen im Jahr 2010 der Stein wieder ins Rollen gebracht: Zusammen mit Dr. Pierre Legrand vom Synchrotron Soleil bei Paris bearbeitete er die Messdaten erneut, so dass selbst die schwächsten Signale der Kristalle noch zur Erstellung der Struktur genutzt werden konnten.
Dazu wurden Daten sowohl in Soleil als auch an der stärksten Röntgen-Messstation der Welt, PETRA-III in Hamburg, gemessen. „Dem Computermodell der Struktur mussten erst wieder Teile entfernt werden, um anhand der Daten erkennen zu können, wo sie richtig angebracht werden mussten. Nach weiteren zweieinhalb Jahren konnten wir die Struktur der RNA Polymerase I schließlich lösen“, so Dr. Grüne.
Originalveröffentlichung: Carlos Fernandez-Tornero et al. Crystal structure of the 14-subunit RNA polymerase I. Published online in Nature. DOI: 10.1038/nature12636.
Kontaktadresse:
Dr. Tim Grüne
Georg-August-Universität Göttingen
Fakultät für Chemie – Institut für anorganische Chemie
Tammannstraße 4, 37077 Göttingen
Telefon (0551) 39-22149, E-Mail: tg@shelx.uni-ac.gwdg.de
Internet: http://shelx.uni-ac.gwdg.de/~tg/
Media Contact
Weitere Informationen:
http://www.uni-goettingen.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















