Verbesserte Kohlendioxid-Fixierung dank Mikrokompartiment
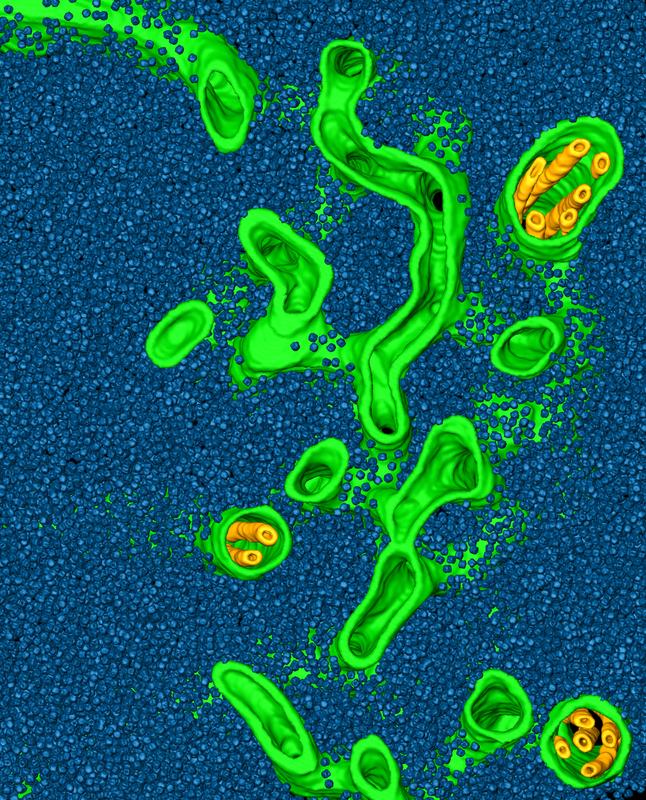
Die Tubulusmembranen (grün und gelb) des Pyrenoids sind umspült von einem “Meer” aus Rubiscoenzymen (blau). © ScienceDirect
Unser Planet erwärmt sich
Das Klima unseres Planeten ist dabei sich zu verändern. Jedes Jahr werden Hitzerekorde gebrochen, die extreme Wetterlagen, schmelzendes Polareis und steigende Meeresspiegel zur Folge haben. Verstärkt wird die globale Erwärmung durch Treibhausgase wie Kohlendioxid, die verhindern, dass Wärme aus der Atmosphäre entweichen kann. Pflanzen und Algen wirken als natürliche Luftfilter diesem Effekt entgegen:
In einem als Photosynthese bezeichneten Prozess nutzen sie die Energie der Sonne, um der Atmosphäre Kohlendioxid zu entziehen. Dabei erzeugen sie Sauerstoff, den wir einatmen. Das wichtigste Protein in diesem Prozess ist Rubisco, das Kohlendioxid bindet.
Etwa die Hälfte der auf der Erde stattfindenden Photosynthese erfolgt durch einzellige Algen im Ozean. Viele dieser Algen binden Kohlendioxid effizienter als Landpflanzen, indem sie Kohlendioxid in einem Mikrokompartiment, dem Pyrenoid, konzentrieren. Bis vor kurzem war nicht bekannt, wie dieses Mikrokompartiment aufgebaut ist.
Jedes Rubisco im Pyrenoid sichtbar machen
Ein erster Durchbruch gelang dem Team von Martin Jonikas, Leiter der Arbeitsgruppen in Carnegie/Stanford und Princeton. Sie identifizierten ein Linkerprotein in der Grünalge Chlamydomonas, das Rubisco-Enzyme innerhalb des Pyrenoids aneinanderbindet.
Ohne diesen „molekularen Klebstoff“ kommt es nicht zur Entstehung des Pyrenoids. Bisher war jedoch nicht bekannt, wie die Rubisco-Proteine in dem Pyrenoid organisiert sind. Lange dachten die Forscher, dass es sich dabei um einen Festkörperkristall höherer Ordnung handeln könnte.
Um dieser Frage nachzugehen, untersuchten Wissenschaftler um Benjamin Engel am Max-Planck-Institut für Biochemie die molekulare Organisation des Pyrenoids in Chlamydomonas-Zellen mittels Kryoelektronentomographie. Im Gegensatz zur klassischen Elektronenmikroskopie, werden bei dieser Technik durch rasches Einfrieren Artefakte vermieden und die Zelle in ihrem nativen Zustand gehalten.
Mit Hilfe dieses hochauflösenden Bildgebungsverfahrens konnten Engel und seine Kollegen genau messen, an welchen Positionen in dem Pyrenoid sich die vielen Tausenden von Rubisco-Enzymen befinden. Sie stellten fest, dass das Pyrenoid keine kristalline Struktur aufweist: „Vergleicht man unsere Messungen mit der Organisation von Molekülen in Flüssigkeiten finden sich deutliche Ähnlichkeiten. Das deutet darauf hin, dass Pyrenoide in Wirklichkeit flüssigkeitsartige Strukturen sind“, erklärt Engel das Ergebnis.
Wie Öl und Wasser
Um zu belegen, dass sich das Pyrenoid wie eine Flüssigkeit verhält, führte Elizabeth Freeman Rosenzweig, Erstautorin der Studie, fluoreszenzspektroskopische Messungen der Bewegung von Rubisco innerhalb lebender Zellen durch. Mit Hilfe eines Hochleistungslasers löschte sie das Signal der an Rubisco gebundenen fluoreszierenden Markierung in einer Hälfte des Pyrenoids, während die Markierung in der anderen Hälfte erhalten blieb. Innerhalb von Minuten breitete sich die Fluoreszenz wieder im gesameten Pyrenoid aus. Die Enzyme konnten sich wie in einer Flüssigkeit hin und her bewegen.
Bei dem Pyrenoid handelt es sich also um ein flüssiges Mikrokompartiment, das in einem zweiten großen Flüssigkeitskompartiment, dem Chloroplasten, schwimmt. Dies ist ein Beispiel für eine „Phasentrennung“, ein physikalisches Phänomen, das, wie kürzlich nachgewiesen wurde, eine Rolle bei der Kompartimentbildung vieler Zellproteine spielt.
Freeman Rosenzweig erläutert dieses Prinzip anhand einer Analogie: „Zwar sind bei der Phasentrennung des Pyrenoids andere Kräfte am Werk, der Vorgang lässt sich aber anhand eines vertrauten Bildes gut veranschaulichen: Stellen Sie sich vor, sie bekommen Essig und Öl in einem italienischen Restaurant.
Beides sind Flüssigkeiten, aber sie vermischen sich nicht. Der Essig bildet stattdessen Tröpfchen, die in dem Öl schwimmen. Genauso bildet unserer Ansicht nach das Pyrenoid ein Tröpfchen innerhalb der flüssigen Umgebung des Chloroplasten.“
Freeman Rosenzweig entdeckte zudem, dass sich zu einem speziellen Zeitpunkt das „Öl” des Chloroplasten-Stromas und der „Essig“ des Pyrenoids doch mischen. Teilen sich einzellige Algen in zwei Tochterzellen, durchläuft das Pyrenoid einen „Phasenübergang”, bei dem es sich teilweise in das ihn umgebende Stroma des Chloroplasten auflöst.
Für gewöhnlich wird das verbleibende Pyrenoid zweigeteilt, wobei jede Tochterzelle eine Hälfte aufnimmt. Zuweilen schlägt diese Teilung jedoch fehl und eine der Tochterzellen geht leer aus. Die Forscher beobachteten, dass Zellen, auf die kein Pyrenoid übergeht, dieses dennoch spontan bzw. „de novo“ herstellen können. Sie vermuten, dass jede Tochterzelle einen Teil der gelösten Pyrenoidkomponenten aufnimmt und sich diese in ähnlicher Weise zu einem neuen Pyrenoid zusammenschließen können – wie Regentropfen aus Wasserdampf kondensieren.
„Wir denken, dass die Auflösung des Pyrenoids vor und seine Kondensation nach der Zellteilung einen redundanten Mechanismus darstellen könnten, der gewährleistet, dass beide Tochterzellen Pyrenoide aufnehmen“, meint Jonikas. „Auf diese Weise verfügen beide Zellen über diese wichtige Organelle, die für die Kohlenstoffaufnahme entscheidend ist.“
Optimierte Kulturpflanzen für eine sich verändernde Welt
Jonikas und seine Arbeitsgruppe haben große Pläne für die Anwendungsmöglichkeiten dieser Erkenntnisse. Sie möchten Pyrenoide auf technischem Wege in Feldfrüchte wie Weizen und Reis einbringen, um so der Klimaveränderung und dem Hunger auf der Welt entgegenzutreten.
„Zu verstehen, wie Algen Kohlendioxid konzentrieren können, ist ein wichtiger Schritt hin zu unserem Ziel, die Photosynthese bei anderen Pflanzen zu verbessern“, so Jonikas. „Wenn wir andere Kulturpflanzen technisch so verändern könnten, Kohlenstoff zu konzentrieren, wäre dies eine Möglichkeit, dem weltweit wachsenden Bedarf an Nahrungsmitteln zu begegnen.“ Jonikas‘ Arbeitsgruppe hat sogar ihr eigenes Maskottchen kreiert – Sammy the Chlamy – das in einem Musikvideo über das große Potential des Pyrenoids aufklärt:
https://www.youtube.com/watch?v=B2ftWvnBanY
Teile dieser Pressemitteilung wurden mit freundlicher Genehmigung der Kommunikationsabteilung der Princeton University übernommen. Das Musikvideo wurde von Jonathan Mann produziert.
[SiM]
Originalpublikation
E.S. Freeman Rosenzweig, B. Xu, L. Kuhn Cuellar, A. Martinez-Sanchez, M. Schaffer, M. Strauss, H.N. Cartwright, P. Ronceray, J.M. Plitzko, F. Förster, N.S. Wingreen, B.D. Engel, L.C.M. Mackinder & M.C. Jonikas. “The Eukaryotic CO2-Concentrating Organelle is Liquid-Like and Exhibits Dynamic Reorganization”. Cell, September 2017
DOI: 10.1016/j.cell.2017.08.008
—
Über Benjamin Engel
Benjamin Engel untersucht die molekulare Architektur von Organellen, darunter das Chloroplast. Mit seinem Team visualisiert er makromolekulare Komplexe in ihrem nativen Zellzusammenhang, die er mittels Kryoelektronentomographie hochauflösend darstellen kann. Engel studierte Molekulare und Zellbiologie an der University of California, Berkeley, in den Vereinigten Staaten. Er promovierte an der University of California, San Francisco. Seit 2011 arbeitet er als PostDoc in der Abteilung „Molekulare Strukturbiologie” von Wolfgang Baumeister am Max-Planck-Institut für Biochemie in Martinsried bei München. Er erhielt das Humboldt-Forschungsstipendium für Postdoktoranden und den MPIB Junior Research Award.
Über das Max-Planck-Institut für Biochemie
Das Max-Planck-Institut für Biochemie (MPIB) in Martinsried bei München zählt zu den führenden internationalen Forschungseinrichtungen auf den Gebieten der Biochemie, Zell- und Strukturbiologie sowie der biomedizinischen Forschung und ist mit rund 35 wissenschaftlichen Abteilungen und Forschungsgruppen und ungefähr 800 Mitarbeitern eines der größten Institute der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. Das MPIB befindet sich auf dem Life-Science-Campus Martinsried in direkter Nachbarschaft zu dem Max-Planck-Institut für Neurobiologie, Instituten der Ludwig-Maximilians-Universität München und dem Innovations- und Gründerzentrum Biotechnologie (IZB). (http://biochem.mpg.de)
Über Martin Jonikas
Martin Jonikas arbeitet als Assistenzprofessor an der Princeton University. In seinem Labor untersucht er photosynthetisch aktive Eukaryoten mit mordernsten Technologien. Er studierte Raumfahrttechnik am Massachusetts Institute of Technology. Während seiner Promotion an der University of California, San Francisco, arbeitete er zusammen mit Jonathan Weissman, Maya Schuldiner und Peter Walter an high-throughput genetics und der Proteinfaltung im Endoplasmatischen Retikulum. Jonikas startete sein Labor direkt nach Erlangen des Doktorgrades als Fakultätsmitglied an der Carnegie Institution for Science und als Assistenzprofessor an der Stanford University. Nach sieben Jahren in Carnegie verlagerte er sein Labor nach Princeton. Für seine Forschung wurde er mit zahlreichen Preisen ausgezeichnet, darunter der Howard Hughes Medical Institute-Simons Foundation Faculty Scholar Award im Jahr 2015, der NIH New Innovator Award im Jahr 2015 und der Air Force Young Investigator Award 2010.
Kontakt:
Dr. Benjamin Engel
Abteilung Molekulare Strukturbiologie
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Germany
Tel. +49 89 8578-2653
E-Mail: engelben@biochem.mpg.de
www.biochem.mpg.de
Dr. Christiane Menzfeld
Öffentlichkeitsarbeit
Max-Planck-Institut für Biochemie
Am Klopferspitz 18
82152 Martinsried
Germany
Tel. +49 89 8578-2824
Mail: pr@biochem.mpg.de
www.biochem.mpg.de
http://www.biochem.mpg.de – Webseite des Max-Planck-Institutes für Biochemie
http://www.biochem.mpg.de/en/rd/baumeister – Webseite der Abteilung „Molekulare Strukturbiologie“ (Wolfgang Baumeister)
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















