Tanz der Proteine: Protein-Bewegungen mit Nanosekunden-Auflösung vermessen

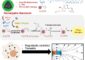
Als sie damit Bewegungen des Proteins Villin untersuchten, fanden sie zwei sonst kaum voneinander unterscheidbare Strukturen: In der einen können schnelle Strukturänderungen stattfinden, die für die Proteinfunktion essentiell sind und im Zeitbereich von Nanosekunden ablaufen, die andere ist starr. Diese Ergebnisse sind in der aktuellen Online Ausgabe der Zeitschrift „Proceedings of the Natural Academy of Sciences, USA“ (PNAS) erschienen.
Eines der fünf wichtigsten Proteine in der Zelle ist das Aktin. Seine Filamente halten die Zelle zusammen und die wichtigsten Bausteine an ihrem Platz. Das Protein Villin vernetzt die langen Aktin-Fasern und trägt so erheblich zur Stabilisierung der Zellstrukturen bei. Der Teil des Villin Proteins, der für die Bindung an Aktinfilamente verantwortlich ist, HP35, war aufgrund seiner geringen Größe in den letzten Jahren Gegenstand einer großen Zahl von Computersimulationen zum Verständnis der Proteindynamik. Doch experimentelle Untersuchungen fehlten, da diese Protein-Bewegungen im Zeitbereich von Mikrosekunden oder sogar Nanosekunden ablaufen, einem Zeitbereich, der bisher experimentell kaum zugänglich war.
Mit einer in der Arbeitsgruppe von Professor Thomas Kiefhaber entwickelten Methode, die auf schnellem Elektronentransfer zwischen verschiedenen Teilen eines Proteins beruht, konnten solche schnellen strukturellen Änderungen nun erstmals direkt untersucht werden. Als Modellsystem wählten sie den Aktin bindenen Teil des Villin-Proteins, HP35. Die neuen experimentellen Arbeiten vom Team um Thomas Kiefhaber zeigen nun, dass das gefaltete Protein in zwei Konformationen vorliegt, die sich strukturell nur wenig unterscheiden, aber sehr unterschiedliche dynamische Eigenschaften besitzen. In einer starren Konformation können keine größeren Strukturänderung stattfinden, während in der flexiblen Konformationen Teile des Proteins, die für die Aktinbindung verantwortlich sind, im Zeitbereich von 100 Nanosekunden falten und entfalten.
Die beiden Konformationen stehen im Gleichgewicht und werden im Zeitbereich von einer Mikrosekunde ineinander umgewandelt. Die strukturelle Ähnlichkeit der beiden Konformationen erklärt, warum sie bisher weder in strukturellen Untersuchungen noch in Computersimulationen entdeckt wurden. Durch den Einsatz von zeitaufgelösten Elektronentransfermessungen können die verschiedenen Zustände jedoch auf Grund ihrer unterschiedlichen Beweglichkeit unterschieden und charakterisiert werden.
Die Erkenntnisse dieser Studie sind von grundlegender Bedeutung für das Verständnis der Funktion von Proteinen und tragen zur Aufklärung der Mechanismen der Faltung und Fehlfaltung von Proteinen bei. Die Forscher hoffen nun, dass sie diese Methode weiterentwickeln können, um sie an größeren Proteinen anzuwenden, die für die Regulation von Zellfunktionen wichtig sind.
Originalpublikation:
Andreas Reiner, Peter Henklein und Thomas Kiefhaber
An unlocking/relocking barrier in conformational fluctuations of villin headpiece subdomain.
Proc. Natl. Acad. Sci. USA, Early Online Edition. doi: 10.1073/pnas.0910001107
Kontakt:
Prof. Dr. Thomas Kiefhaber
Technische Universität München
Lehrstuhl für Biophysikalische Chemie
Lichtenbergstr. 4
85748 Garching, Germany
Tel: +49 89 289 13420
Fax: +49 89 289 13416
E-mail: t.kiefhaber@ch.tum.de
Weitere Informationen:
http://www.pnas.org/content/early/2010/02/25/0910001107.abstract Originalpublikation
http://dante.phys.chemie.tu-muenchen.de Homepage des Lehrstuhls
http://www.youtube.com/watch?v=AlfvWESPyZY Computersimulationen zur HP35 Faltung (I)
http://www.youtube.com/watch?v=gvKu3cDeoeA Computersimulationen zur HP35 Faltung (II)
Media Contact
Weitere Informationen:
http://portal.mytum.de/welcomeAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…