Synthetischer Antikörper ermöglicht erstmals kontrollierbaren „Protein-Knockdown“ in Wirbeltieren
Mikroskopische Aufnahme von lebenden HeLa-Zellen Jörg Mansfeld
Vielleicht der wichtigste Grundbaustein aller Zellen sind Proteine, die vielfältigste Funktionen in Zellen und Geweben wahrnehmen. Um die physiologische Rolle solcher Proteine aufzuklären, werden diese oftmals über gezielte genetische Manipulation mit einem grünfluoreszierenden Protein (GFP) verknüpft und so mikroskopisch sichtbar gemacht.
Die Beobachtung solcher GFP-verknüpften Proteine in lebenden Zellen erlaubt es Schlüsse zur Funktion des Proteins zu ziehen. Die konkrete Funktion eines Proteins lässt sich aber oftmals erst ermitteln, wenn das Protein entfernt wird und die Konsequenzen in der Zelle, im Gewebe oder im Modellorganismus sichtbar werden.
Dies wird meist durch einen Knockout des Proteins auf der genetischen Ebene erreicht. Proteine mit lebenswichtigen Funktionen können so allerdings nicht ausgeschaltet werden, da in diesem Fall die Zelle oder der Modellorganismus nicht lebensfähig sind.
Hier müssen Verfahren angewandt werden, in denen Proteine nur gezielt zu einem konkreten Untersuchungszeitpunkt in den Zellen entfernt werden. Solch ein zielgerichteter vorübergehender Abbau von Proteinen kommt in Pflanzen durch das Pflanzenhormon Auxin vor. Der zugrundeliegende Mechanismus lässt sich nach genetischer Manipulation auch in tierischen und menschlichen Zellen anwenden.
Um GFP-verknüpfte Proteine in lebenden Zellen nicht nur beobachten, sondern auch zielgerichtet rasch abbauen zu können, wurde in der Forschungsgruppe um Dr. Jörg Mansfeld ein neuartiger AID-Nanobody entwickelt. Dazu wurde die Auxin-Erkennungssequenz (AID) mit einem GFP erkennenden Antikörper, wie er in kamelartigen Tieren vorkommt (Nanobody), verknüpft.
Es konnte gezeigt werden, dass dieser sogenannte AID-Nanobody bei Zugabe von Auxin innerhalb von Minuten bis wenigen Stunden den nahezu vollständigen Abbau von GFP-verknüpften Zielproteinen in menschlichen Zellen erlaubt. Die Möglichkeit, den Abbau des Proteins dazu „live“ am Mikroskop zu verfolgen, erleichtert die funktionelle Analyse ungemein.
In Zusammenarbeit mit der Arbeitsgruppe von Dr. Caren Norden wurde gezeigt, dass der AID-Nanobody auch erfolgreich im Modellorganismus Zebrafisch eingesetzt werden kann. Durch Anwendung des Verfahrens am Zebrafisch konnte erstmals demonstriert werden, dass ein Auxin-vermittelter „Protein-Knockdown“ auch in komplexen Wirbeltiermodellen umsetzbar ist.
„Unsere Arbeit ist ein exzellentes Beispiel für die Biotechnologie, bei der verschiedene in der Natur vorkommende Prinzipien, wie in unserem Fall das fluoreszierende GFP aus Algen, der Auxin abhängige Proteinabbau aus Pflanzen, und der Nanobody aus Kamelen kombiniert werden, um bisher nicht zugängliche Forschungsfragen beantworten zu können“, sagt Dr. Katrin Daniel aus dem Mansfeld Lab zu den Ergebnissen des Forschungsprojekts.
Die Entwicklung des AID-Nanobodys ist beispielhaft für die Synergien, die am Wissenschaftsstandort Dresden durch die enge Zusammenarbeit von Arbeitsgruppen verschiedener Forschungsinstitute erzielt werden können.
Finanzierung
Jörg Mansfeld wird von der Deutschen Forschungsgemeinschaft (DFG) gefördert (Emmy Noether; MA 5831/1-1) und vom Europäischen Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union (Fördervereinbarung Nr. 680042). Katrin Daniel wurde vom Maria-Reiche-Programm der TU Dresden gefördert. Caren Norden wurde von der Deutschen Forschungsgemeinschaft (DFG) [SFB 655, A25] und dem Human Frontier Science Program (CDA-00007/2011) unterstützt.
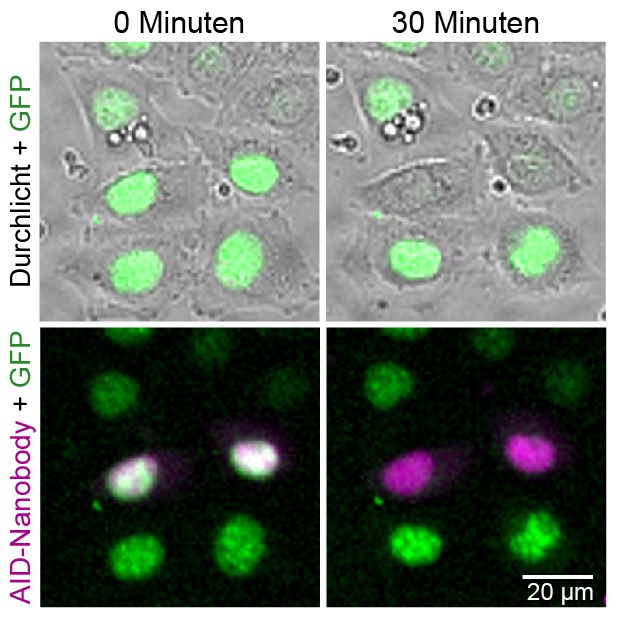
Bildunterschrift Mikroskopie: Mikroskopische Aufnahme von lebenden HeLa-Zellen, in denen ein GFP-verknüpftes Protein (grün) und der AID-Nanobody (magenta) vorhanden sind. Nach Zugabe des Pflanzenhormons Auxin wird das GFP-verknüpfte Protein gezielt in den AID-Nanobody enthaltenden Zellen innerhalb von 30 Minuten abgebaut. © Jörg Mansfeld
Informationen für Journalisten:
Friederike Braun, M.A. (PR Officer)
Tel.: +49 351 458-82064
E-Mail: friederike.braun@tu-dresden.de
Das Biotechnologische Zentrum (BIOTEC) wurde 2000 als zentrale wissenschaftliche Einrichtung der Technischen Universität Dresden mit dem Ziel gegründet, modernste Forschungsansätze in der Molekular- und Zellbiologie mit den in Dresden traditionell starken Ingenieurswissenschaften zu verbinden. Seit 2016 ist das BIOTEC eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden. Innerhalb der TU Dresden nimmt das BIOTEC eine zentrale Position in Forschung und Lehre mit dem Schwerpunkt „Molecular Bioengineering und Regenerative Medizin“ ein. Es trägt damit entscheidend zur Profilierung der TU Dresden im Bereich moderner Biotechnologie und Biomedizin bei. Die Forschungsschwerpunkte der internationalen Arbeitsgruppen bilden die Zellbiologie, die biologische Physik und die Bioinformatik.
Katrin Daniel, Jaroslav Icha, Cindy Horenburg, Doris Müller, Caren Norden and Jörg Mansfeld: “Conditional control of fluorescent protein degradation by an auxin-dependent nanobody”
DOI: 10.1038/s41467-018-05855-5
Nature Communication: http://www.nature.com/ncomms
http://www.mansfeldlab.com
http://www.mpi-cbg.de/de/forschungsgruppen/uebersicht/caren-norden/group-leader/
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















