RUB-Forscher entschlüsseln Zusammenspiel von Enkephalinen und Schmerzrezeptoren
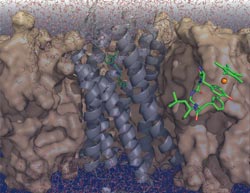
Der Enkephalin-Rezeptor (grau) durchspannt die Zellmembran. In Grün ist die Struktur des freien Enkephalins im Komplex mit dem Rhodiumatom (orange) gezeigt. Grafik: Florian Wieberneit (AG Biomolekulare NMR)<br>
„Schmerz lass nach!“ Um dieses Signal zu senden, produziert der menschliche Körper kleine Botenstoffmoleküle, die an bestimmte Rezeptoren andocken. Dieses Zusammenspiel zwischen den Botenstoffen, Enkephaline genannt, und Opioidrezeptoren ist mit herkömmlichen biochemischen Methoden schwer zu untersuchen.
Einem interdisziplinären Team von Biochemikern und Anorganischen Chemikern der Ruhr-Universität Bochum (RUB) gelang es nun, die Struktur eines Enkephalins in Lösung zu bestimmen und erstmals seine Interaktion mit dem Opioidrezeptor im Detail zu verfolgen. Die Analyse liefert präzise neue Ansatzpunkte für die Entwicklung von Medikamenten, die gezielt bestimmte Arten von Schmerz bekämpfen. Die Zeitschrift „Dalton Transactions“ widmet dem Thema die Titelgeschichte.
Rhodium erlaubt Analyse von Enkephalinen in Lösung
Enkephalin ist ein Peptid; es besteht aus Aminosäuren. In Lösung ist es sehr flexibel, sodass Forscher das kleine Molekül nur schwer für Strukturanalysen „zu fassen“ bekommen. Die RUB-Chemiker nutzten einen Trick: In das Enkephalin brachten sie einen Komplex ein, der das Edelmetall Rhodium enthielt und in der Natur nicht vorkommt. Die Struktur des Metall-Peptid-Komplexes untersuchten sie dann mit kernmagnetischer Resonananzspektroskopie, kurz NMR (nuclear magnetic resonance). Mit gebundenem Rhodium ließ sich das Enkephalin wesentlich umfassender beobachten als zuvor. In Computersimulationen berechneten die Forscher dann, wie sich die mit NMR bestimmte Struktur des Enkephalins optimal in die bekannte dreidimensionale Struktur des Rezeptors einpassen lässt.
Rund 40 Jahre nach der Entdeckung
Die Enkephaline wurden als erste Neuropeptide überhaupt bereits in den 70er-Jahren entdeckt und intensiv erforscht. Die zugehörigen Opioidrezeptoren, die zur Klasse der sogenannten G-Protein-gekoppelten Rezeptoren gehören, entzogen sich jedoch jahrzehntelang der Strukturanalyse. Erst im vergangenen Jahr wurden einige ihrer Strukturen aufgeklärt, und der Chemie-Nobelpreis 2012 für die Erforschung der G-Protein-gekoppelten Rezeptoren brachte neuen Schwung in das Arbeitsgebiet. „Jetzt plötzlich – etwa 40 Jahre nach der Entdeckung der Enkephaline – können wir auf atomarer Ebene verstehen, wie diese Botenstoffe an ihre Rezeptoren binden“, sagt Prof. Dr. Nils Metzler-Nolte, der die RUB-Arbeitsgruppe Medizinische Anorganische Chemie leitet. „Unsere Arbeit zeigt, wie der gezielte Einsatz von in der Natur nicht vorkommenden Metallkomplexen durchaus einen Beitrag liefern kann, seit langem offene Fragen in der Medizin zu klären“, ergänzt Prof. Dr. Raphael Stoll von der AG Biomolekulare Spektroskopie.
Förderung und Vorarbeiten
Die Deutsche Forschungsgemeinschaft (FOR 630 und SFB 642) und die RUB Research School unterstützten die vorliegenden Arbeiten. Sie bauen auf der früheren Zusammenarbeit der Arbeitsgruppen um Nils-Metzler Nolte und Raphael Stoll mit Prof. Dr. Richard H. Fish vom Lawrence Berkeley National Laboratory in Kalifornien auf. Im vergangenen Jahr zeigte das Team erstmals, wie Metallkomplexe bei Strukturuntersuchungen helfen können.
Titelaufnahme
F. Wieberneit, A. Korste, B. Albada, N. Metzler-Nolte, R. Stoll (2013): Structural and biological implications of the binding of Leu-enkephalin and its metal derivatives to opioid receptors, Dalton Transactions, DOI: 10.1039/C3DT50635E
Weitere Informationen
Prof. Dr. Nils Metzler-Nolte, Anorganische Chemie I, Fakultät für Chemie und Biochemie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24153, E-Mail: nils.metzler-nolte@rub.de
Prof. Dr. Raphael Stoll, AG Biomolekulare Spektroskopie, Fakultät für Chemie und Biochemie der Ruhr-Universität, 44780 Bochum, Germany, Tel. 0234/32-25466, E-Mail: raphael.stoll@rub.de
Angeklickt
Frühere Presseinformation zu Metall-Peptid-Komplexen
http://aktuell.ruhr-uni-bochum.de/pm2012/pm00237.html.de
Cover-Bild
http://pubs.rsc.org/en/content/articlepdf/2013/dt/c3dt90091f?page=search
Redaktion: Dr. Julia Weiler
Media Contact
Weitere Informationen:
http://www.ruhr-uni-bochum.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue Industrie-4.0-Lösung für niedrigschwelligen Zugang zu Datenräumen
»Energizing a Sustainable Industry« – das Motto der Hannover Messe 2024 zeigt klar, wie wichtig eine gleichermaßen leistungsstarke und nachhaltige Industrie für den Fertigungsstandort Deutschland ist. Auf der Weltleitmesse der…

Quantenpräzision: Eine neue Art von Widerstand
Physikforschende der Universität Würzburg haben eine Methode entwickelt, die die Leistung von Quantenwiderstands-Normalen verbessern kann. Sie basiert auf einem Quantenphänomen namens anomaler Quanten-Hall-Effekt. In der industriellen Produktion oder in der…

Sicherheitslücke in Browser-Schnittstelle erlaubt Rechnerzugriff über Grafikkarte
Forschende der TU Graz waren über die Browser-Schnittstelle WebGPU mit drei verschiedenen Seitenkanal-Angriffen auf Grafikkarten erfolgreich. Die Angriffe gingen schnell genug, um bei normalem Surfverhalten zu gelingen. Moderne Websites stellen…