Pfade ausleuchten im Fischgehirn
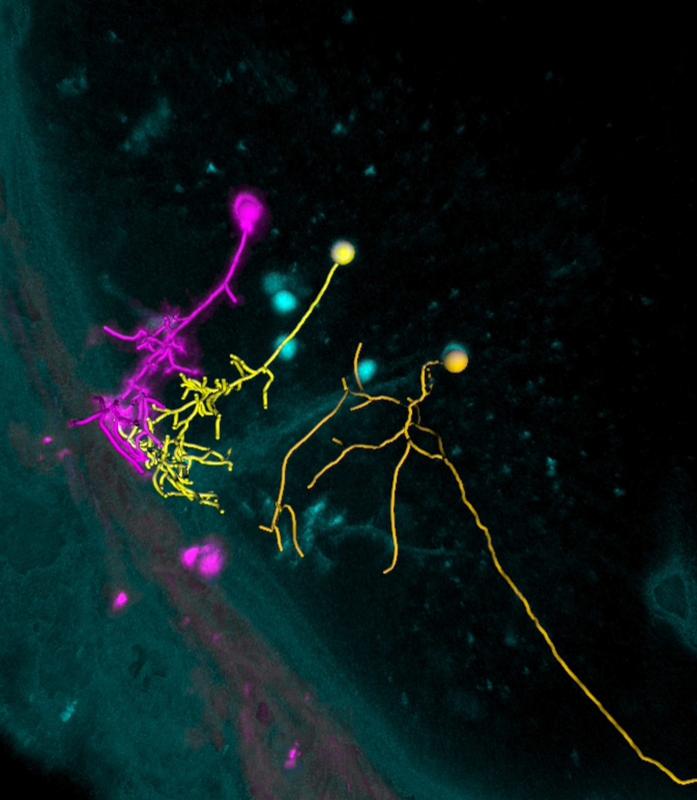
Forscher können einzelne Nervenzellen im Zebrafischgehirn mit Licht aktivieren (magenta) und beobachten, welche benachbarten Zellen mit der Zelle im gleichen Schaltkreis verbunden sind (gelb). © Max-Planck-Institut für Neurobiologie / Förster
Moderne Methoden geben immer detailliertere Einblicke in den Aufbau und die Funktionen des Gehirns. Durch das Mikroskop zeigt sich, wann und wo Nervenzellen bei einer bestimmten Aktion aktiv sind. Ob die aktiven Zellen jedoch untereinander verbunden sind, oder in welcher Reihenfolge sie Informationen austauschen, bleibt dabei meist unsichtbar. Solche Informationen konnten bisher nur teilweise und mit großem Aufwand mit Methoden der Elektrophysiologie oder der Elektronenmikroskopie gewonnen werden.
In der Elektrophysiologie wird die Aktivität benachbarter Zellen mit Hilfe hauchdünner Nadeln gemessen. Dies ist jedoch in sehr dichtem oder tiefem Hirngewebe kaum möglich und lange Verbindungswege können nur schwierig nachvollzogen werden. Zudem können nur Impulse von wenigen Zellen gleichzeitig gemessen werden.
Bei modernen Elektronenmikroskopie-Verfahren (Konnektomik) werden in einem präparierten Gehirn alle Nervenzellen und ihre Verbindungen Schicht für Schicht von einem Rasterelektronenmikroskop erfasst und dann am Computer rekonstruiert. So werden zwar Zellverbindungen sichtbar, die dynamische Informationsweitergabe eines lebenden Gehirns bleibt dabei jedoch verborgen.
Beide Ansätze haben somit deutliche Limitierungen. „Wir haben nach einem Weg gesucht, um die Verbindungen und Informationsweitergabe von Nervenzellen im aktiven Gehirn beobachten zu können, ohne das Gehirn zu schädigen, ja, es nicht einmal zu berühren“, erklärt Dominique Förster. Mit dieser Motivation entwickelten Förster und seine Kollegen aus der Abteilung von Herwig Baier am Max-Planck-Institut für Neurobiologie die Optobow-Methode.
Farbmarkierungen für aktive Zellen
Mit Hilfe gentechnischer Verfahren schleusten die Forscher den lichtempfindlichen „ChrimsonR“-Ionenkanal in einzelne Nervenzellen im Gehirn von Zebrafischlarven ein. Die Nervenzellen in der Umgebung dieser ChrimsonR-Zellen brachten die Wissenschaftler dazu, „GCaMP6“, einen sogenannten Kalzium-Indikator, zu produzieren. An GCaMP6 gekoppelt war wiederum ein hellfluoreszierendes Protein, mit dem die Forscher die Form der Nervenzelle einschließlich ihrer feinen Verästelungen und Synapsen sichtbar machen konnten.
„Das klingt erst einmal kompliziert, und die Entwicklung hat auch einiges an Zeit gekostet – aber das Ergebnis ist beeindruckend“, freut sich Dominique Förster über die neue Methode. Da Zebrafischlarven und auch ihr Gehirn durchsichtig sind, konnten die Max-Planck-Forscher die ChrimsonR-Zellen allein durch das Anstrahlen der Fische mit Licht aktivieren. Dass das Licht dabei gezielt auf einzelne Nervenzellen auch tief im Gehirn traf, war erst durch eine fast zeitgleich von Labor-Kollegen entwickelte zweite Methode möglich. (Mehr über diese Zwei-Photonen holographische Optogenetik findet sich über den Link am Ende des Textes.)
Die Forscher konnten somit einzelne ChrimsonR-Zellen im lebenden Fischgehirn durch Licht aktivieren. Löste die ChrimsonR-Zelle ein Aktionspotential in einer Nachbarzelle aus, reagierte dort der Kalzium-Indikator auf den damit verbundenen Ionen-Einstrom und das fluoreszierende Protein ließ die Zelle farblich aus der Masse hervortreten. So konnten die Wissenschaftler live unter dem Mikroskop beobachten, welche Nervenzelltypen wann und wo nach Aktivierung der Ausgangszelle aktiviert wurden.
Neue Methode mit großem Potential
Wie nützlich die neue Methode ist, konnten die Forscher bereits in ihren ersten Versuchen belegen: Im untersuchten Bereich des Zebrafischgehirns konnten sie zeigen, dass eine Information als Abbild in dem Gehirnbereich bleibt, bevor sie an andere Bereiche weitergeleitet wird. „Ich wüsste nicht, mit welcher anderen lichtmikroskopischen Methode wir diese Verbindung hätten entdecken können“, freut sich auch Herwig Baier, der Leiter der Studie.
„Mit Optobow können wir nun erstmals im Gehirn eines lebenden, aktiven Tiers beobachten, welche Nervenzellen untereinander verschaltet sind, wenn zum Beispiel ein Verhaltenskommando im Gehirn generiert wird.“ Optobow sollte das Identifizieren der zellulären Komponenten neuronaler Schaltkreise und auch das Verständnis ihrer Funktion deutlich vorantreiben und dadurch Elektrophysiologie und Konnektomik ergänzen. Auch dynamische Veränderungen in den Zellverbindungen, wie zum Beispiel während des Lernens und der Entwicklung, können nun leichter erforscht werden.
ORIGINALVERÖFFENTLICHUNG
Dominique Förster, Marco Dal Maschio, Eva Laurell, Herwig Baier
An optogenetic toolbox for unbiased discovery of functionally connected cells in neural circuits
Nature Communications, online am 24. Juli 2017
KONTAKT
Dr. Stefanie Merker
Presse- und Öffentlichkeitsarbeit
Max-Planck-Institut für Neurobiologie, Martinsried
Tel.: 089 8578 – 3514
E-Mail: merker@neuro.mpg.de
Prof. Dr. Herwig Baier
Abteilung Gene – Schaltkreise – Verhalten
Max-Planck-Institut für Neurobiologie, Martinsried
Tel.: 089 8578 3200
Email: hbaier@neuro.mpg.de
http://www.neuro.mpg.de/baier/de – Webseite der Abteilung von Prof. Herwig Baier
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Anlagenkonzepte für die Fertigung von Bipolarplatten, MEAs und Drucktanks
Grüner Wasserstoff zählt zu den Energieträgern der Zukunft. Um ihn in großen Mengen zu erzeugen, zu speichern und wieder in elektrische Energie zu wandeln, bedarf es effizienter und skalierbarer Fertigungsprozesse…

Ausfallsichere Dehnungssensoren ohne Stromverbrauch
Um die Sicherheit von Brücken, Kränen, Pipelines, Windrädern und vielem mehr zu überwachen, werden Dehnungssensoren benötigt. Eine grundlegend neue Technologie dafür haben Wissenschaftlerinnen und Wissenschaftler aus Bochum und Paderborn entwickelt….

Dauerlastfähige Wechselrichter
… ermöglichen deutliche Leistungssteigerung elektrischer Antriebe. Überhitzende Komponenten limitieren die Leistungsfähigkeit von Antriebssträngen bei Elektrofahrzeugen erheblich. Wechselrichtern fällt dabei eine große thermische Last zu, weshalb sie unter hohem Energieaufwand aktiv…





















