Neue Methode visualisiert die Sprache von Nervenzellen
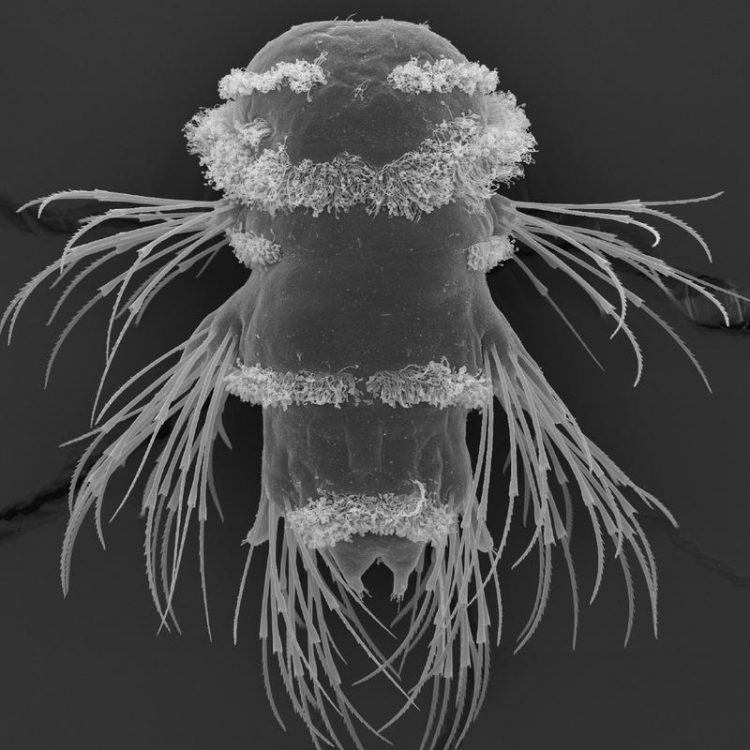
Elektronenmikroskopbild einer Platynereislarve. Von einer solchen Larve wurden 5.000 Gewebeschnitte angefertigt und mittels siGOLD analysiert. Réza Shahidi /Max-Planck-Institut für Entwicklungsbiologie
Wissenschaftler versuchen schon lange zu verstehen, wie das Nervensystem funktioniert. Dazu müssen sie wissen, wie einzelne Nervenzellen miteinander verbunden sind. Eine Möglichkeit besteht darin, einen neuronalen Schaltplan zu erstellen, das so genannte Konnektom.
Ein Konnektom ähnelt einem elektrischen Schaltplan und enthält Informationen über die Verbindungen von Neuronen (Axone und Dendriten) und wie diese über Synapsen miteinander in Verbindung stehen. Nerven kommunizieren nicht nur über elektrische Signale, sondern auch über Signalmoleküle, so genannte Neuropeptide und Neurotransmitter, die von einer Nervenzelle zur anderen übertragen werden. Die Signalmoleküle werden von verschiedenartigen Neuronen produziert und bestimmen, wie die Nervenzellen einander beeinflussen.
Um die Neuropeptide direkt den entsprechenden Neuronen im Konnektom zuordnen zu können, haben Jékely und sein Team eine neue, hochauflösende und schnelle Methode entwickelt. Um ganze neuronale Schaltkreise zu rekonstruieren, müssen sehr dünne Gewebeschnitte des Nervengewebes im hochauflösenden Elektronenmikroskop (EM) dargestellt werden. Die Kombination der Einzelschnitte erlaubt, den Neuronen durch die Schnitte hindurch zu folgen.
Die Wissenschaftler haben kleine Neuropeptide identifiziert, die sich für die EM eignen. Diese Neuropeptide kommen im ganzen Nervensystem vor, wobei jedes charakteristisch für eine bestimmte Art von Neuronen ist. Die Forscher synthetisierten Antikörper, die gezielt nur ein Neuropeptid erkennen. Diese Antikörper sind mit Goldpartikel gekoppelt, die die Neuropeptide als schwarze Punkte in den EM-Schnitten sichtbar machen.
Die Wissenschaftler färbten verschiedene Schnitte mit unterschiedlichen Antikörpern, um verschiedene Neurone zu markieren. Die neue Methode haben die Forscher siGOLD (kurz für „serial-multiplex Immunogold“) getauft. siGOLD erlaubt die vollständige dreidimensionale Rekonstruktion von Nervenzellen und ihren Zellverbänden
Jékelys Gruppe arbeitet mit winzigen Larven des marinen Plancktons Platynereis dumerilii, einer Borstenwurm-Art. „Die Größe spielt eine wichtige Rolle“, so Jékely, „Platynereis ist ungefähr 12.000 mal kleiner als ein Mäusehirn, sodass wir das neuronale Netzwerk der Larve durch serielle EM sehr viel schneller rekonstruieren können“.
Neuropeptide sind in Tieren weit verbreitet und wichtig für die Funktion des Nervensystems. Daher ist siGOLD auch für andere Organismen eine geeignete Methode. “Wir sind zuversichtlich, dass das siGOLD-Verfahren auch bei anderen Organismen anwendbar ist”, sagt Reza Shahidi, Erstautor der Studie. „Viele Neuropeptide der Platynereis-Larve, wie zum Beispiel Enkephalin, kommen auch in den Nervensystemen anderer Organismen vor.”
siGOLD macht es möglich, dass hochauflösende EM-Bilder und die Information, mit welchen Signalmolekülen einzelne Nervenzellen kommunizieren, verknüpft werden.
Zur Methode
Um zu verstehen, wie das Nervensystem funktioniert, brauchen Wissenschaftler nicht nur genaue Kenntnisse der Anatomie der Nervenverbindungen, sondern müssen auch wissen, welche Moleküle von jeder Nervenzelle eines Konnektoms ausgeschüttet werden. Synapsen, also die Verbindungsstellen zwischen zwei Nervenzellen, liegen im Nanometerbereich. Mittels hochauflösender Elektronenmikroskopie kann man solche Nervenverbindungen erkennen.
Für die EM muss das Nervengewebe fixiert und in Plastik-Harz eingebettet werden. Dieses wird mit einer Diamantklinge in sehr dünne, meist nur 40 nm breite Scheiben geschnitten. Von jedem Schnitt wird dann ein sehr hoch aufgelöstes Bild aufgenommen, in dem man alle Membranen und Synapsen erkennen kann. Kombiniert man später die Schnitte, kann man den Nervenzellen durch alle Schnitte hindurch folgen und so eine 3D-Rekonstruktion des gesamten neuronalen Schaltplans erstellen. Réza Shahidi, Erstautor der Studie, hat 5.000 einzelne Schnitte einer kompletten Larve des marinen Borstenwurms Platynereis dumerilii analysiert. Bis zu diesem Zeitpunkt wissen die Forscher noch nicht, mit welchen Signalmolekülen die verbundenen Nervenzellen kommunizieren.
Der Nachteil bisheriger Verfahren, mit denen Neuropeptide sichtbar gemacht werden können, liegt darin, dass die Auflösung oft unzureichend ist. Außerdem sind für die Expression von bestimmten Markern gentechnische Methoden nötig. Dadurch können nur wenige unterschiedliche Marker eines einzelnen Organismus analysiert werden.
Jékely und seine Arbeitsgruppe identifizierten eine Reihe von Neuropeptiden, die die Fixierung und Aufbereitung für die Elektronenmikroskopie unbeschadet überstehen. Diese Antikörper sind mit winzigen Goldpartikeln verbunden, die das Anfärben einzelner Nervenzellen erst ermöglichen. Jékely und sein Team haben 11 unterschiedliche Antikörper verwendet und konnten so über 80 verschiedene Nervenzellen rekonstruieren.
Originalpublikation:
Réza Shahidi, Elizabeth A. Williams, Markus Conzelmann, Albina Asadulina, Csaba Verasztó, Sanja Jasek, Luis A. Bezares-Calderón and Gáspár Jékely: A Serial Multiplex Immunogold Labeling Method for Identifying Peptidergic Neurons in Connectomes. Veröffentlicht December 15, 2015
Cite as eLife 2015;10.7554/eLife.11147
DOI: http://dx.doi.org/10.7554/eLife.11147
http://elifesciences.org/content/early/2015/12/15/eLife.11147
Ansprechpartner:
Gáspár Jékely
Max-Planck-Institut für Entwicklungsbiologie
Tel.: 07071 601-1310
E-Mail: gaspar.jekely@tuebingen.mpg.de
Nadja Winter (Pressereferentin)
Tel.: 07071 601-444
Mail: presse-eb@tuebingen.mpg.de
Über uns:
Das Max-Planck-Institut für Entwicklungsbiologie betreibt Grundlagenforschung auf den Gebieten der Biochemie, Molekularbiologie, Genetik sowie Zell- und Evolutionsbiologie. Es beschäftigt rund 360 Mitarbeiterinnen und Mitarbeiter und hat seinen Sitz auf dem Max-Planck-Campus in Tübingen. Das MPI für Entwicklungsbiologie ist eines der 83 Institute und Forschungseinrichtungen der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V.
Der Max-Planck-Campus Tübingen beherbergt die Max-Planck-Institute für Entwicklungsbiologie, biologische Kybernetik und Intelligente Systeme/Standort Tübingen sowie das Friedrich-Miescher-Laboratorium. Insgesamt arbeiten und forschen rund 900 Personen auf dem Campus.
http://elifesciences.org/content/early/2015/12/15/eLife.11147
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















