Markierung von Proteinen mit Ubiquitin ermöglicht neue Forschung zur Zellregulation
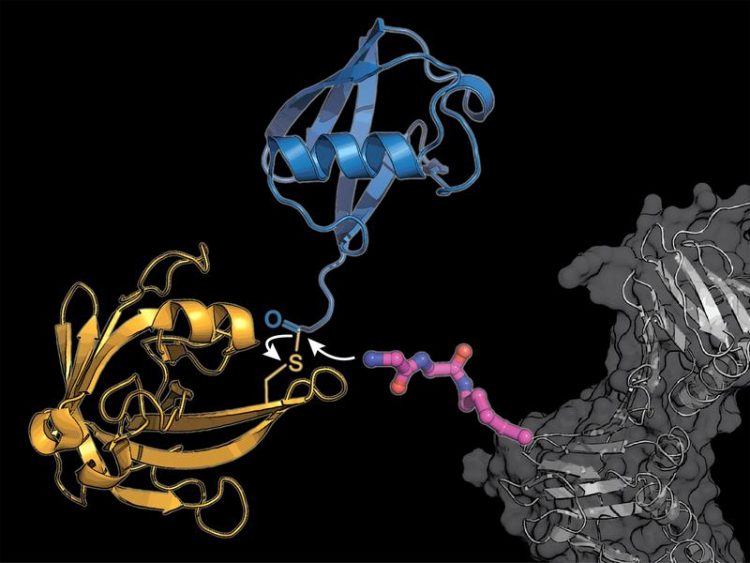
In ein zelluläres Protein (grau) bauten die Forschenden einen modifizierten Lysin-Aminosäurebaustein ein (pink), auf den das bakterielle Enzym Sortase (gelb) ein Ubiquitin-Molekül (blau) überträgt. Bild: K. Lang / TUM
Pflanzen haben es, Pilze, Tiere und auch Menschen: das Protein Ubiquitin. Es besteht aus einer Abfolge von 76 Aminosäuren und ist damit ein eher kleines Biomolekül.
Doch sein Einfluss ist weitreichend: Art, Position und Anzahl der an ein Protein gebundenen Ubiquitin-Moleküle bestimmen Stabilität, Funktion und Aufenthaltsort des Proteins innerhalb der Zelle.
„Praktisch jeder Prozess in der Zelle wird direkt oder indirekt durch Ubiquitin beeinflusst. Daher werden Fehlfunktionen dieses Markierungsmechanismus mit dem Entstehen und Fortschreiten von Krebs und vielen anderen schweren Krankheiten in Verbindung gebracht“, erklärt Kathrin Lang, Professorin für Synthetische Biochemie an der TU München.
Die Entdeckung der Rolle dieses zellulären Regulierungssystems beim kontrollierten Abbau von zu entsorgenden Proteinen wurde 2004 mit dem Chemie-Nobelpreis ausgezeichnet.
Wie Ubiquitin-Modifikationen im Einzelnen die Funktion der Zelle beeinflussen, ist jedoch in vielen Fällen ungeklärt. Kathrin Langs Team hat nun ein Verfahren entwickelt, mit dem sich Ubiquitin-Markierungen gezielt an Zielproteinen anbringen lassen – ein Schlüssel zur Erforschung des Systems.
Ein bakterielles Enzym schafft neue Verbindungen
Die Strategie des Teams umgeht das komplizierte natürliche System mit zwei Tricks: In natürliche Proteine wird zunächst eine modifizierte Aminosäure eingebaut, an die dann das aus Bakterien stammende Enzym Sortase ein Ubiquitin oder ein Ubiquitin-ähnliches Molekül anhängen kann.
„Die größte Herausforderung lag darin, die verschiedenen Schritte – den Einbau der nicht natürlichen Aminosäure in ein Zielprotein und die Übertragung des Ubiquitins durch das Enzym Sortase – so aufeinander abzustimmen, dass sie nicht nur im Reagenzglas sondern auch in lebenden Zellen funktionieren“, erinnert sich Maximilian Fottner, der Erstautor der Studie.
Mittlerweile haben die Forscher an der TU München ihr neues Verfahren für viele verschiedene zelluläre Proteine optimiert und zum Patent angemeldet.
„Wir haben bereits Kooperationen mit Medizinern und Zellbiologen gestartet, die nun gemeinsam mit uns die Auswirkungen von Ubiquitin-Markierungen auf das Entstehen von Krebs und neurodegenerativen Erkrankungen wie Parkinson auf molekularer Ebene studieren wollen“, freut sich Prof. Lang.
Mehr Informationen:
Bei ihren Forschungsarbeiten kooperierte das Team von Kathrin Lang mit den Gruppen von Prof. Ville R. I. Kaila, Professur für Computergestützte Biokatalyse der TU München und der Gruppe von Dr. Anja Bremm von der Goethe Universität Frankfurt am Main.
Gefördert wurden die Arbeiten durch Mittel der Deutschen Forschungsgemeinschaft (DFG) im Rahmen des Exzellenz-Clusters Center for Integrated Protein Science Munich (CIPSM), das Internationale Graduiertenkolleg GRK 1721, sowie die Sonderforschungsbereiche SFB 1309, SFB 1035 und das Schwerpunktprogramm SPP 1623. Kathrin Lang ist im Rahmen ihrer Rudolf Mößbauer Tenure Track-Professur Fellow des Institute for Advanced Study der TUM.
Prof. Dr. Kathrin Lang
Technische Universität München
Professur für Synthetische Biochemie
Lichtenbergstr. 4, 85748 Garching
Tel.: +49 89 289 13836 – E-Mail: kathrin.lang@tum.de
Site-specific ubiquitylation and SUMOylation using genetic-code expansion and sortase
Maximilian Fottner, Andreas-David Brunner, Verena Bittl, Daniel Horn-Ghetko,
Alexander Jussupow , Ville R. I. Kaila, Anja Bremm and Kathrin Lang
Nature Chemical Biology, 15, 276–284 (2019) – DOI: 10.1038/s41589-019-0227-4
Link: https://www.nature.com/articles/s41589-019-0227-4
Nature Chemical Biology, News & Views: Decoding without the cipher
Amit Kumar Singh Gautam, Andreas Matouschek
Nature Chemical Biology, 15, 210–212 (2019) – DOI: 10.1038/s41589-019-0230-9
Link: https://www.nature.com/articles/s41589-019-0230-9
https://www.tum.de/nc/die-tum/aktuelles/pressemitteilungen/detail/article/35322/ Link zur Presseinformation
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Mehr Prozess- und Produktinnovationen in Deutschland als im EU-Durchschnitt
Mehr als jedes 3. Unternehmen (36 %) in Deutschland hat zwischen 2018 und 2020 (aktuellste Zahlen für die EU-Länder) neue Produkte entwickelt, Neuerungen von Wettbewerbern imitiert oder eigene Produkte weiterentwickelt….

Nanofasern befreien Wasser von gefährlichen Farbstoffen
Farbstoffe, wie sie zum Beispiel in der Textilindustrie verwendet werden, sind ein großes Umweltproblem. An der TU Wien entwickelte man nun effiziente Filter dafür – mit Hilfe von Zellulose-Abfällen. Abfall…

Entscheidender Durchbruch für die Batterieproduktion
Energie speichern und nutzen mit innovativen Schwefelkathoden. HU-Forschungsteam entwickelt Grundlagen für nachhaltige Batterietechnologie. Elektromobilität und portable elektronische Geräte wie Laptop und Handy sind ohne die Verwendung von Lithium-Ionen-Batterien undenkbar. Das…





















