Licht im Maschinenraum eines Helferproteins
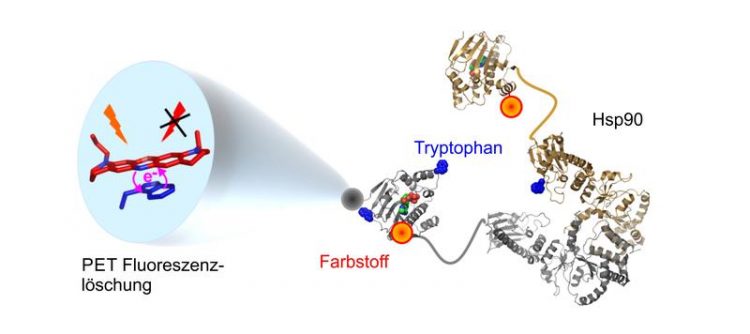
Die Kombination aus Farbstoffmolekül und Tryptanophan liefert bisher ungekannte Einblicke in die Bewegungen des Proteins Hsp90. Grafik: Hannes Neuweiler
Proteine zählen zu den wichtigsten Funktionsträgern des Lebens. Gebildet aus langen Ketten von Aminosäuren, falten sie sich in hochgeordnete dreidimensionale Strukturen, ähnlich wie ein Origami-Puzzle. Gefaltete Proteine sind allerdings nicht starr, sondern veränderlich und in ständiger Bewegung. Somit können sie als molekulare Maschinen eine Vielzahl von Funktionen ausführen, die in ihrer Gesamtheit das Leben ausmachen.
Gedrängel in der Enge führt zu Fehlern
Lebende Zellen sind voll von solchen Proteinen, die sich während der Faltung und beim Ausführen ihrer Funktionen jedoch häufig ins Gehege kommen. „Kommt es bei diesem Gedränge zu Fehlern in der Faltung oder in der Funktion, können diese eine Reihe von Erkrankungen bis hin zu Krebs auslösen“, erklärt Dr. Hannes Neuweiler.
Neuweiler ist Gruppenleiter am Lehrstuhl für Biotechnologie & Biophysik der Universität Würzburg. Zusammen mit seiner Arbeitsgruppe hat er eine Technik entwickelt, durch die Proteine bei der Arbeit mit hoher Orts- und Zeitauflösung beobachtet werden können. In der aktuellen Ausgabe der Fachzeitschrift Nature Chemical Biology stellt die Gruppe die Ergebnisse ihrer Arbeit vor.
Neuweiler und sein Team haben sich für diese Arbeit auf sogenannte Helferproteine – in der Fachsprache Chaperone genannt, von englisch: „begleiten, bemuttern“ – konzentriert. „Chaperone greifen sich andere Proteine, die Hilfe benötigen. Sie helfen ihren ‚Patienten‘ bei der Faltung, aktivieren sie, indem sie ihre Form verändern, und verhindern unerwünschte Zusammenlagerungen“, erklärt Neuweiler.
Ein Hitzeschockprotein mit Heilkunst
Eine außergewöhnliche Variante solcher Helferproteine ist das Hitzeschockprotein Hsp90: Es zählt zu den am häufigsten vorkommenden Proteinen in der lebenden Zelle, wo es sich um eine sehr große Zahl von „Patienten“ kümmert, die unterschiedlichste Formen und Funktionen haben. „Die Heilkunst von Hsp90 ist jedoch ein Mysterium. Sein genauer Funktionsmechanismus ist bislang nur teilweise verstanden“, sagt Neuweiler.
Bekannt war: Das Chaperon ähnelt einer molekularen Klammer, die sich öffnet und schließt, während es seinen Patienten verarztet. Mit Hilfe kristallographischer Methoden und der Technik der Röntgenbeugung haben Forscher in der Vergangenheit atomar aufgelöste Strukturen von Hsp90 ermittelt, die Schnappschüsse aus dem Maschinenraum des Helferproteins zeigen. „Bis zum heutigen Tage war es jedoch nicht möglich, diese Mechanik von Hsp90 bei der Arbeit in wässriger Lösung zu beobachten“, so Neuweiler. Es fehlten Methoden, die solch lokale Bewegungen in Proteinen sichtbar machen können.
Ein Leuchtfeuer zeigt Strukturveränderungen
Das hat sich jetzt geändert: Die Würzburger Wissenschaftler haben hochauflösende Fluoreszenzsonden entwickelt, mit deren Hilfe es möglich ist, diese Bewegungen in Hsp90 zu beobachten. Wie ein Leuchtfeuer, das bei Strukturänderung ein- und ausgeschaltet wird, zeigen die Sonden an, wann und auf welcher Zeitskala eine Bewegung in der molekularen Maschine stattfindet.
Hierbei machen sich die Forscher das Phänomen der Fluoreszenzlöschung durch photoinduzierten Elektronentransfer (PET) zu Nutze. Das Prinzip: Synthetische Farbstoffmoleküle, die unter normalen Umständen Licht aussenden, werden bei Kontakt mit der natürlich vorkommenden Aminosäure Tryptophan durch eine photochemische Reaktion ausgeschaltet. Neuweiler und Mitarbeiter haben solche Farbstoffmoleküle nun an ausgewählte Stellen in Hsp90 in die Nachbarschaft von Tryptophan eingebracht und das Chaperon dadurch mit Bewegungsmeldern ausgestattet. Die Ergebnisse der Arbeit zeigen, dass sich lokale Strukturelemente in Hsp90 synchron bewegen, während die molekulare Klammer sich schließt. Das kooperierende Protein Aha1, ein sogenanntes Co-Chaperon, legt den Hebel eines ausgewählten Strukturelements von Hsp90 in einer frühen Phase um und beschleunigt somit den Vorgang.
In zukünftigen Arbeiten wollen die Wissenschaftler nun mit Hilfe der neuen Fluoreszenztechnik weitere Strukturänderungen in Hsp90 und die Wirkungsweise anderer Co-Chaperone beleuchten. Von den Untersuchungen am Einzelmolekül mit Hilfe sensitiver bildgebender Verfahren erwarten sie neue Einblicke in die Mechanik von Helferproteinen und damit auch Erkenntnisse über die Entstehung von Krankheiten.
“Cooperation of local motions in the Hsp90 molecular chaperone ATPase mechanism”, Andrea Schulze, Gerti Beliu, Dominic A. Helmerich, Jonathan Schubert, Laurence H. Pearl, Chrisostomos Prodromou & Hannes Neuweiler. Nature Chemical Biology
Kontakt
Dr. Hannes Neuweiler, T: +49 931 31-83872, E-Mail: hannes.neuweiler@uni-wuerzburg.de
http://dx.doi.org/10.1038/nchembio.2111 Zur Originalpublikation
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















