Klumpen als Zwischenlager
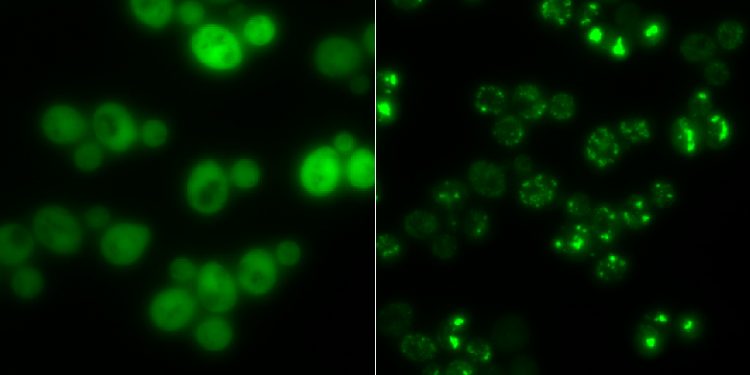
Hefezellen ohne Proteinaggregate (links) und solche mit (hell leuchtende Punkte): In Hungerzeiten dienen solche Klumpen als Zwischenlager für Proteine. Gruppe Prof. Matthias Peter / ETH Zürich
Proteinaggregate haben einen schlechten Ruf: Etliche Krankheiten des Menschen, insbesondere solche des Nervensystems wie Alzheimer, Parkinson oder Amyotrophe Lateralsklerose (ALS) sind darauf zurückzuführen, dass sich in den Nervenzellen entartete Proteine zusammenlagern und so Aggregate entstehen, welche die Zellen nicht auflösen können. Dadurch sterben die Zellen ab.
In einer Studie bei Hefezellen rücken Forscher um ETH-Professor Matthias Peter und Reinhard Dechant nun aber Proteinaggregate in ein neues Licht. Die entsprechende Arbeit ist soeben in der Fachzeitschrift «Nature Cell Biology» erschienen.
Die ETH-Wissenschaftler zeigen darin auf, dass sich solche Proteinklumpen in Hefezellen bei Stressfaktoren wie Nahrungsentzug oder Hitze bilden. Nach überstandenem Stress können die Zellen die Aggregate wieder auflösen und die einzelnen Bestandteile rasch rezyklieren und im Zellstoffwechsel einsetzen.
Bei Stress bilden sich Klumpen
Als Beispiel für ein Protein, das bei Stress zusammenklumpt, entdeckten die Forscher das Enzym Cdc19. Es stellt für die Zelle Energie bereit. Die Forscher fanden heraus, dass Cdc19 bei Entzug von Glucose in seine vier identischen Untereinheiten zerfällt. Diese verändern dann ihre ursprüngliche Form und lagern sich mit weiteren Molekülen wie Ribonukleinsäuren oder anderen Enzymen in Aggregaten zusammen.
Die Forscher nennen solche Klumpen Stresskörperchen (engl. stress granules). Einmal in ein solches Aggregat eingebunden, wird Cdc19 inaktiv, und es ist nicht mehr in der Lage, Brennstoff für die Zelle zu erzeugen. Während dieser Zeit kann die Zelle weder wachsen noch sich vermehren.
Der Vorgang ist jedoch umkehrbar. Sobald der Stress vorbei ist, lösen sich die Stresskörperchen auf, die vier Untereinheiten von Cdc19 lagern sich zusammen, sodass das Enzym seine Arbeit im Zuckerstoffwechsel wiederaufnehmen kann.
Die Klumpen haben also einen klaren Zweck, sagt Matthias Peter: «Die Hefezelle benutzt Aggregate als eine Art Lagerstätte für wichtige Enzyme, damit diese in Stresssituationen nicht abgebaut und nach überlebtem Stress sofort reaktiviert werden können.» Die Aggregate würden diese Moleküle vor dem Abbau durch die zelleigene Entsorgungsmaschinerie schützen. Müsste die Zelle diese Verbindungen nach jeder Stresssituation von neuem aufbauen, würde dies die Zelle viel Zeit und Energie kosten.
Einfache Sequenz reicht für Verklumpung aus
Die Forscher klärten zudem auf, wie und weshalb Cdc19 verklumpen kann. Sie identifizierten in der Struktur einer Cdc19-Untereinheite einen kurzen, ungefalteten und einfach aufgebauten Teilbereich. In der Fachsprache werden solche Bereiche «Low Complexity Regions» (LCR) genannt. Sie kommen laut den Forschern auch in anderen aggregatbildenden Proteinen weiterer Organismen vor, unter anderem auch beim Menschen.
«Die LCR werden durch den Zerfall des Enzymkomplexes exponiert und lösen die Aggregation aus», weiss Peter. «Für uns war es deshalb wichtig, eine solche Sequenz bei Cdc19 ausfindig zu machen. Das bestätigt einen allgemeinen Mechanismus.» Bei der Hefe ist die LCR von Cdc19 im Normalzustand versteckt oder trägt mehrere Phosphatgruppen, welche die LCR «handlungsunfähig» machen. Erst bei Ernährungsstress tritt die LCR hervor, und die Phosphatgruppen werden entfernt. Erst dann können sich Aggregate bilden.
Wichtige Erkenntnis
«Unsere Forschung hat in der Wissenschaftsgemeinschaft für eine Aufbruchstimmung gesorgt», sagt Reinhard Dechant, Gruppenleiter am Institut für Biochemie, der die Studie zusammen mit Matthias Peter leitete. Bislang habe man vor allem Aggregate als krankmachende Partikel betrachtet, weil man in Patienten stets nur das Ergebnis des Vorgangs – unauflösbare Proteinplaques, welche eine Krankheit verursachen – sehe. «Unsere Arbeit beleuchtet auch den Anfang der Aggregatbildung und deren Verlauf», sagt Dechant. Proteinklumpen würden sich nicht ausschliesslich aufgrund einer Krankheit bilden, sondern weil die Zelle diese brauche, um eine Stresssituation zu überleben. «Wir konnten zum ersten Mal zeigen, dass sowohl die Bildung als auch die Auflösung von Aggregaten ein wichtiger Mechanismus von Zellen ist.»
Zu ähnlichen Erkenntnissen gelangten früher auch andere Forschungsgruppen der ETH Zürich, die solche Aggregate in Hefezellen untersuchen. So konnten andere ETH-Wissenschaftler aufzeigen, dass Klumpen aus entarteten Proteinen unter anderem wie ein Gedächtnis funktionieren und den Zellen helfen, vergangene (negative) Erfahrungen abzuspeichern (ETH-News berichtete). Es scheint daher, dass die funktionelle Aggregation von bestimmten Proteinen ein weitverbreiteter Regulationsmechanismus darstellt.
Literaturhinweis
Saad S, Cereghetti G, Feng Y, Picotti P, Peter M, Dechant R. Reversible protein aggregation is a protective mechanism to ensure cell cycle restart after stress. Nat Cell Biol. 2017 Oct;19(10):1202-1213. doi: 10.1038/ncb3600. Epub 2017 Aug 28.
https://www.ethz.ch/de/news-und-veranstaltungen/eth-news/news/2017/10/protein-ag…
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















