Klein und effizient – Wasser-Nanotröpfchen kühlen Biomoleküle ultraschnell
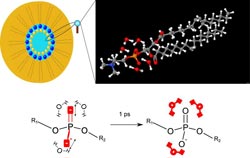
Links oben: Schematische Darstellung einer aus Phospholipidmolekülen bestehenden inversen Mizelle. Die Phosphatgruppen der Lipidmoleküle (blaue Kugeln) sind an der inneren Oberfläche der Mizelle angeordnet. Wassermoleküle befinden sich im Innern der Mizelle. Rechts oben: Vergrößerte Ansicht der Struktur eines Phospholipidmoleküls. Sauerstoffatome sind in rot, Wasserstoffatome in weiß, Kohlenstoffatome in grau, das Stickstoffatom in blau und das Phosphoratom in orange dargestellt. Die gewinkelten Wassermoleküle befinden sich in der Umgebung der Phosphatgruppe (PO4). Unten: Schema der Energieübertragung. In den Experimenten ist zunächst die (asymmetrische) Streckschwingung der Phosphatgruppe angeregt (rote Sauerstoffatome O). Nach dem Zerfall der Schwingungsanregung wird die freiwerdende Energie innerhalb einer Pikosekunde auf die umgebende Wasserhülle übertragen (rote Wassermoleküle H2O). Abb. MBI<br>
Biochemische Prozesse laufen überwiegend in wässriger Umgebung ab. Dabei werden bestimmte Gruppen eines Biomoleküls in eine Hülle aus Wassermolekülen eingebettet, d.h. hydratisiert. Die Wasserhülle stabilisiert die biomolekulare Struktur und ermöglicht den Energieaustausch zwischen Biomolekül und Umgebung.
Beispiele für derartige Systeme sind die DNS-Doppelhelix, der Träger genetischer Information, in wässriger Umgebung, und die aus Phospholipiden bestehende äußere Membran lebender Zellen. Die molekularen Mechanismen, die Geschwindigkeit und Effizienz des Energieaustausches zwischen Biomolekül und Wasserhülle bestimmen, sind erst in Ansätzen verstanden und deshalb Gegenstand aktueller Forschung.
Forscher des Max-Born-Instituts haben jetzt gezeigt, dass kleinste Wasser-„Tröpfchen“ in der Umgebung eines Lipidmoleküls einen Energietransfer im Zeitbereich unterhalb 1 ps, d.h. in weniger als 1 Millionstel einer Millionstel Sekunde ermöglichen. Wie René Costard, Christian Greve, Ismael Heisler und Thomas Elsässer in der neuesten Ausgabe der Zeitschrift Journal of Physical Chemistry Letters (Band 3, Seite 3646, 2012) berichten, reichen 3 an die Phosphatgruppe des Lipids gekoppelte Wassermoleküle aus, um Schwingungsenergie aus dem Lipid effizient zu übertragen und in thermische Energie der Wasserhülle zu verwandeln.
Dabei wird die Wasserhülle um 10 bis 20 °C erwärmt. Die thermische Energie steckt vorwiegend in Kippbewegungen der Wassermoleküle, sog. Librationen, und führt zu einer Schwächung der Wechselwirkung zwischen den Wassermolekülen, den sog. Wasserstoffbrücken. Die molekulare Struktur der Wasserhülle bleibt auf der Zeitskala der Energieübertragung nahezu unverändert. Dieser extrem effiziente Mechanismus erlaubt auch die Übertragung größerer Energiemengen und kann so das Lipidmolekül vor Beschädigungen seiner Struktur durch Überhitzung schützen.
In den Experimenten wurde ein Phospholipid-Modellsystem untersucht, das aus DOPC-Molekülen besteht (Abb.1). Diese Moleküle sind als sog. inverse Mizellen angeordnet, in deren Innern die Phosphatgruppen (PO4) der Lipidmoleküle hydratisiert werden. Dabei lässt sich der Wassergehalt in weiten Grenzen verändern. Zur Untersuchung des Energietransfers wurde mit Lichtimpulsen von ca 0.1 ps Dauer entweder eine Phosphatschwingung des Lipids oder die OH-Streckschwingung von Wassermolekülen angeregt.
Beide Schwingungen zerfallen in Bruchteilen einer Pikosekunde und geben die dabei freiwerdende Energie an die Wasserhülle ab. Dieser Übertragungs- und Umverteilungprozess wurde durch Messung transienter zweidimensionaler Schwingungsspektren der OH-Streckschwingung des Wassers verfolgt (Abb. 2). Die Schwächung der Wasserstoffbrücken in der aufgeheizten Wasserhülle führt zu einer Verschiebung der OH-Streckschwingung zu höheren Frequenzen. Aus der zeitabhängigen Veränderung dieser Spektren lässt sich direkt die Dynamik der Energieübertragung ableiten.
Ansprechpartner:
René Costard, costard@mbi-berlin.de, Tel. 030 6392 1454
Dr. Ismael Heisler, heisler@mbi-berlin.de
Prof. Thomas Elsässer, elsasser@mbi-berlin.de
Originalpublikation:
R. Costard, C. Greve, I. A. Heisler, T. Elsaesser: Ultrafast energy redistribution in local hydration shells of phospholipids: a two-dimensional infrared study. J. Phys. Chem. Lett. 3, 3646 (2012).
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















