Wie Grünalgen im Dunkeln überleben

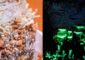
Grünalgen im Licht (links) und in luftdicht verschlossenen Flaschen im Dunkeln (rechts). <br>© RUB, Foto: AG Photobiotechnologie<br>
Wenn die Sonne scheint, kurbeln Mikroalgen wie Chlamydomonas reinhardtii ihren Stoffwechsel – wie alle höheren Pflanzen – durch Fotosynthese an. Dabei wandeln sie Sonnenlicht in Sauerstoff (O₂), chemische Energie und Zellbestandteile um.
Ist es dunkel, stellen die Einzeller ihren Stoffwechsel auf Zellatmung um, die bei uns Menschen die einzige Möglichkeit ist, effizient lebenswichtige Energie herzustellen. Diese Zellatmung aber benötigt Sauerstoff, der im Erdboden, wo die Alge mitunter lebt, Mangelware ist. Chlamydomonas geht die Luft aus.
Gemeinsam mit Kollegen der UC Los Angeles und der Michigan State University berichten RUB-Forscher in der Zeitschrift „The Plant Cell“ in einem Large Scale Biology-Artikel, wie sich das genetische Programm der Grünalge unter dieser Stressreaktion verändert.
Gesamtumstellung des Zellstoffwechsels
In der AG Photobiotechnologie arbeiten Dr. Anja Hemschemeier und Prof. Dr. Thomas Happe schon lange gemeinsam an der Frage, wie sich Grünalgen an den Sauerstoffmangel anpassen und den Zellstoffwechsel umstellen: „Sauerstoffmangel ist für Algen und Pflanzen ein größeres Problem, als viele denken“, erklärt Hemschemeier. „Die meisten unserer Kulturpflanzen, wie etwa Kartoffeln, bekommen Probleme, wenn der Erdboden überflutet wird. Dann bekommen die unterirdischen Organe nicht genug Sauerstoff.“
Algen zapfen alle Ressourcen an
Mittels Nukleinsäuresequenzierung gelang es den Wissenschaftlern, Schnappschüsse der Grünalgen-Gene unter unterschiedlichen Bedingungen zu machen – einmal mit, einmal ohne Sauerstoff. Aus den Unterschieden konnten sie ableiten, wie die Zellen genetisch reagieren. So veränderte sich die Aktivität von fast 1.500 Genen, wenn die Chlamydomonas-Kulturen von sauerstoffreicher Atmosphäre im Licht in sauerstoffarme Bedingungen im Dunkeln gebracht wurden. Die RUB-Forscher schauten sich jedes einzelne der veränderten Gene mithilfe wissenschaftlicher Datenbanken an, um deren Funktion ableiten zu können. Anschließend erstellten sie Gruppen von Genen, die gemeinsam bestimmten Stoffwechselwegen zugeordnet werden konnten. Daraus leiteten sie einen bestimmten Trend ab: „Anhand der funktionellen Gengruppen kann man ganz deutlich ablesen, dass die Algen auf die Energiekrise strikt ökonomisch reagieren“, fasst Hemschemeier zusammen. „Sie fahren energieaufwendige Prozesse wie die Zellteilung herunter und versuchen gleichzeitig, jede interne Energiequelle anzuzapfen. Sie ähneln in gewisser Weise dem Menschen, der bei Hungerphasen auch auf den Abbau von Kohlenhydraten, Fetten und Eiweißen zurückgreift.“
Fettreserven für bessere Zeiten
Während diese Anpassungen der Grünalge zu erwarten waren, gab es auch Überraschungen: Trotz des Mangels an Energie bauten die Zellen Fettreserven auf. Dies ist eine bekannte Stressreaktion von Mikroalgen. Allerdings unterscheiden sich die Fette der sauerstofflimitierten Grünalge deutlich von bisher untersuchten und enthalten viele wertvolle ungesättigte Fettsäuren. Die RUB-Wissenschaftler nehmen an, dass Chlamydomonas diese Fettsäuren sicher verstaut, um sie bei einem Wechsel zu besseren Bedingungen rasch hervorzaubern und so schneller wieder zum normalen Zellstoffwechsel übergehen zu können.
Vielschichtige Regulationsvorgänge
Wie genau die Algen merken, dass kein Sauerstoff da ist, und wie sie dann diese Information umsetzen in veränderte genetische Aktivitäten und schließlich den Stoffwechsel anpassen, verstehen die Wissenschaftler erst ansatzweise. Bislang kennt man nur wenige Kandidaten, die in sauerstofflimitierten Chlamydomonas-Zellen regulativ wirken. Im März dieses Jahres konnte das RUB-Team beispielsweise in der Zeitschrift „PNAS“ veröffentlichen, dass ein Hämoglobin und Stickstoffmonoxid an den genetischen Anpassungsreaktionen beteiligt sind. In ihren neusten Untersuchungen gab es zudem weitere Hinweise auf Regulationsvorgänge durch Stickstoffmonoxid, aber auch eine Signalwirkung des Fotosyntheseapparates sowie Ähnlichkeiten zu Sauerstoffsensoren beim Menschen stellten sich heraus. „Es sieht so aus, dass die Mikroalge verschiedenste Wege nutzt, um den Stoffwechsel an Sauerstoffmangel und Dunkelheit anzupassen“, fasst Thomas Happe zusammen. Einzelne Aspekte dieser Vorgänge wollen die RUB-Forscher nun im Detail untersuchen. Sie erhoffen sich dadurch neue Erkenntnisse über Reaktionen von Lebewesen an Sauerstoffmangel, der in so unterschiedlichen Bereichen wie Landwirtschaft, Energieerzeugung und Medizin eine wichtige Rolle spielt.
Titelaufnahme
A. Hemschemeier, D. Casero, B. Liu, C. Benning, M. Pellegrini, T. Happe, S.S. Merchant (2013): COPPER RESPONSE REGULATOR1-dependent and -independent responses of the Chlamydomonas reinhardtii transcriptome to dark anoxia, Plant Cell, doi 10.1105/tpc.113.115741
Weitere Informationen
Dr. Anja Hemschemeier, AG Photobiotechnologie, Lehrstuhl Biochemie der Pflanzen, Fakultät für Biologie und Biotechnologie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24282
anja.hemschemeier@rub.de
Angeklickt
Presseinformation zur Genregulation in sauerstofflimitierten Grünalgen (PNAS-Artikel)
http://aktuell.ruhr-uni-bochum.de/pm2013/pm00181.html.de
AG Photobiotechnologie
http://www.ruhr-uni-bochum.de/pbt/
Redaktion: Dr. Maren Volkmann
Media Contact
Weitere Informationen:
http://www.ruhr-uni-bochum.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…