Fische ohne Flossen – Fehler im Zelltransport hat fatale Folgen
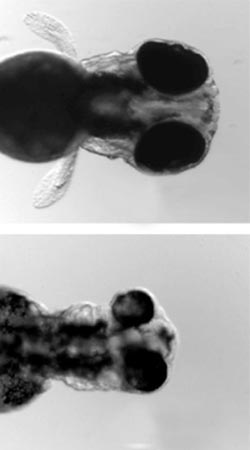
Obereres Bild: Zebrafischembryo mit Brustflossen. Unteres Bild: Zebrafischembryo, bei dem der AP-1-Enzym-Komplex ausgeschaltet wurde, ohne Brustflossen.<br><br>Autor: Marnix Wieffer<br>
Ohne AP-1 kann kein lebensfähiges Wirbeltier entstehen – ist eines der Gene für das Protein ausgeschaltet, entwickeln sich beispielsweise Mäuse nicht über das frühe Embryonalstadium hinaus.
Die Gruppe um Volker Haucke am Leibniz-Institut für Molekulare Pharmakologie (FMP) hat nun aufgeklärt, welche Rolle AP-1 zusammen mit einem assoziierten Enzym im Inneren der Zelle spielt: Es dient als Sortiersignal für Membranvesikel im Inneren der Zelle, und das hat weitreichende Folgen.
Zunächst konnten die FMP-Forscher durch hochauflösende Fluoreszenzaufnahmen zeigen, dass AP-1 als Teil eines Proteinkomplexes durch die Zelle wandert. Durch die Katalyse eines bestimmten Enzyms (PI4-Kinase vom Typ 2β) wird es zusammen mit diesem Enzym an Membranvesikel gebunden. Solche Vesikel schnüren sich an der Membran des Trans-Golgi Netzwerkes ein und bewegen sich durch das Innere der Zelle: Wie auf einem Rangierbahnhof werden so beständig Stoffe aufgenommen, zu zellulären Mülldeponien weitergereicht, oder auch recycelt und so zur Außenmembran zurücktransportiert. Für die Aufklärung dieser Transportwege wurde 2013 der Nobelpreis für Medizin verliehen.
Wie aber kann der Vesikeltransport über die Aktivierung von Genen im Zellkern entscheiden? Auf die richtige Spur kamen die FMP-Forscher, als sie den AP-1-Enzym-Komplex in Zebrafischen ausschalteten.
„Bei den nur wenige Tage alten Embryonen der Fische wuchsen daraufhin keine Brustflossen – das ist mit Menschen vergleichbar, denen die Arme fehlen“, erklärt Volker Haucke. Über die Entstehung von Brustflossen aber sind bereits viele Details bekannt: Sie entwickeln sich aus frühen knospenförmigen Strukturen, wenn darin zum richtigen Zeitpunkt Zellen durch ein bestimmtes, Signal, das WNT-Molekül aktiviert werden.
Der WNT-Signalweg ist ein altes Entwicklungsprogramm, das früh in der Evolution entstand und in allen Wirbeltieren, so auch im Menschen wirkt. Das WNT-Molekül bindet dabei an einen Rezeptor, der aus der Zelle herausragt. Dadurch wird im Zellinneren eine Signalkette in Gang gesetzt, die kaskadenartig Gene im Zellkern anschaltet, die über die weitere Entwicklung entscheiden. Dabei wird der WNT-Rezeptor als Teil eines Vesikels ins Zellinnere geschleust, und hier kommt es zu einer wichtigen Weichenstellung: Bindet der AP-1-Komplex an das Vesikel, dann wandert dieses zurück zur Außenmembran. Der Rezeptor ragt nun wieder aus der Zelle heraus und kann aufs Neue aktiviert werden. Fehlt aber der Weichensteller AP-1, dann wandert das Vesikel mitsamt Rezeptor auf eine Art Mülldeponie. Er wird dann im Inneren der Zelle verdaut – mit tödlichen Folgen für die Entwicklung des Embryos.
„Wir haben erstmals gezeigt, wie der WNT-Signalweg durch den Vesikeltransport reguliert wird“, freut sich FMP-Direktor Volker Haucke.
Zugleich ist die Entdeckung medizinisch relevant: Bei verschiedenen Krebserkrankungen, zum Beispiel Brust- und Darmkrebs, ist der WNT-Signalweg im erwachsenen Menschen fälschlicherweise aktiv. Krebsgeschwüre mit WNT-Aktivierung sind dabei oft besonders aggressiv und schwer therapierbar. Der AP-1-Komplex und das diesen regulierende Enzym, ohne den der WNT-Signalweg nicht funktioniert, könnten daher Ansätze für die Entwicklung künftiger Therapien sein.
Current Biology 23, 1–6, November 4, 2013
Leibniz-Institut für Molekulare Pharmakologie (FMP)
Ob Kopfschmerzen, Bluthochdruck oder Infektionen – bei vielen Beschwerden helfen heute einfache Tabletten. Doch für etliche Krankheiten gibt es immer noch keine Heilung. Neue Medikamente waren früher meist glückliche Zufallsfunde. Inzwischen wollen Wissenschaftler aber herausfinden, was bei Krankheiten im Körper eigentlich schiefläuft und gezielt Wirkstoffe dafür entwickeln. Das FMP erforscht dafür die wichtigsten Bausteine der Körperzellen, die Proteine (Eiweißstoffe). Dabei handelt es sich um unendlich wandelbare Moleküle – sie katalysieren Reaktionen, übermitteln Signale und bilden das Grundgerüst des Lebens. Mit den unterschiedlichsten Methoden erforschen die Wissenschaftler am FMP die Form der Protein-Moleküle, wie sie funktionieren und mit welchen Wirkstoffen man sie beeinflussen kann. Daraus wird einmal die Medizin der Zukunft. Das FMP ist ein Institut der Leibniz-Gemeinschaft und des Forschungsverbunds Berlin.
Media Contact
Weitere Informationen:
http://www.fmp-berlin.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















