Einblick in die Kinderstube der Proteine
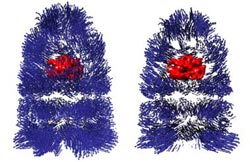
Proteinfaltung im geschlossenen GroEL-GroES-Komplex: Die blauen Pfeile zeigen die Bewegung des umhüllenden Helferproteins während der Faltung des Substratproteins (rot) in seinem Innern an. Quelle: Forschungszentrum Jülich<br>
Einem internationalen Wissenschaftlerteam ist es erstmals gelungen, ein Zwischenstadium der Faltung im Hohlraum des weitverbreiteten Chaperons GroEL zu analysieren. Die Ergebnisse wurden in der renommierten Fachzeitschrift Cell veröffentlicht.
Proteine sind als lange Ketten aufgebaut, die in der Regel aus einigen Hundert aneinandergereihten Aminosäurebausteinen bestehen. Wie sie es schaffen, innerhalb von Sekundenbruchteilen die korrekte Gestalt anzunehmen, ist immer noch ein großes Rätsel. Fehlfaltungen können schwerwiegende Folgen haben, Mediziner führen heute ein breites Spektrum unterschiedlicher Erkrankungen auf missgestaltete Proteine zurück, neben Krebs, Diabetes oder Arterienverkalkung auch viele neurodegenerative Erkrankungen wie Alzheimer oder Parkinson.
Nicht alle Proteine sind in der Lage, sich selbstständig korrekt im Raum zu verknäueln. Helferproteine, Chaperons – so die französischstämmige Bezeichnung für „Anstandsdame“ – unterstützen sie dabei, bestimmte Abschnitte der Aminosäurekette zu charakteristischen, spiralförmigen Helices zusammenzurollen oder in ziehharmonikaförmige Faltblatt-Strukturen zu legen. Auf diese Weise wird ein Großteil der hydrophoben, also der wasserabweisenden, Enden ins Molekülinnere gekehrt. So wird verhindert, dass sich die Proteine über diese hydrophoben Enden vorzeitig miteinander verbinden und zusammenklumpen.
GroEL ist eines der am weitesten verbreiteten Chaperons, das in fast allen bisher analysierten Bakterienarten vorkommt. Nahe Verwandte sorgen auch in Mehrzellern dafür, unfertige Proteine in die richtige Form zu bringen. Das Riesenmolekül besteht aus zwei Ringen, die zusammen eine Art Röhre bilden, in der sich das unfertige Proteinsubstrat ungestört zusammenlegen kann. Um die Aushöhlung während des Faltvorgangs nach außen abzudichten, kommt ein weiteres Helferprotein hinzu, das Co-Chaperon GroES, das sich wie ein Deckel auf die Öffnung legt.
„Bislang war unbekannt, welche molekularen Vorgänge für diese Verkapselung verantwortlich sind und wie das Helferprotein die Proteinfaltung im Innern konkret beeinflusst. Die neuen Erkenntnisse könnten dazu beitragen, diese Fragen besser zu verstehen“, freut sich Prof. Dieter Willbold, Leiter des Jülicher Forschungsbereichs Strukturbiochemie am Institute of Complex Systems (ICS-6), über die Ergebnisse aus seinem Institutsbereich. Die elektronenmikroskopischen Untersuchungen zeigen erstmals, an welcher Stelle ein noch unvollständig gefaltetes Protein andockt, wenn sich der Deckel des GroEL-GroES-Komplexes schließt.
„Wir konnten nachweisen, dass die Anbindung des Proteins die symmetrische Anordnung der Untereinheiten zerstört, aus denen GroEL zusammengesetzt ist“, erläutert Jun.-Prof. Gunnar Schröder, der die in Cell erschienene Studie gemeinsam mit Forschern aus den USA verfasst hat. Wissenschaftler hatten lange nach einem Mechanismus gesucht, der es GroEL ermöglicht, sowohl das unfertige Proteinsubstrat in seinem Innern als auch den „molekularen Deckel“ GroES anzubinden. „Es hat sich gezeigt, dass die Proteinfaltung durch eine Formänderung von GroEL eingeleitet wird“, so Schröder, Leiter der am ICS-6 angesiedelten Jülicher Nachwuchsgruppe Computational Structural Biology. Durch die Verformung vergrößert sich wiederum der Hohlraum im Innern des Helferproteins – möglicherweise, um mehr Platz für die Proteinfaltung zu schaffen.
Zur Untersuchung der Proteinstruktur kam die sogenannte Cryo-Elektronenmikroskopie zum Einsatz. Die Methode bietet den Vorteil, dass Proteine oder Viren nur verhältnismäßig einfach mit flüssigem Ethan heruntergekühlt werden müssen. Nachteil: Die erzielbare Auflösung von etwas weniger als einem Nanometer reicht in vielen Fällen nicht aus, um die atomare Struktur der untersuchten Makromoleküle zuverlässig zu rekonstruieren. Bei der Auswertung der Daten setzten die Wissenschaftler daher auf ein neues Korrekturverfahren, das Gunnar Schröder und sein Jülicher Kollege Benjamin Falkner wenige Wochen zuvor in der Fachzeitschrift PNAS vorgestellt hatten.
Das zugrunde liegende Kreuzvalidierungsverfahren ermöglicht es, die mit dem Elektronenmikroskop gewonnenen Daten mit bereits bekannten Informationen über die Molekülstruktur abzugleichen. Das Verfahren ist nicht ganz neu. Es hat sich seit über 20 Jahren in der Röntgenstrukturanalyse bewährt, mit der sich atomare Strukturen von deutlich höherer Qualität bestimmen lassen. Die Untersuchung mit Röntgenstrahlung ist allerdings auf Kristallgitterstrukturen beschränkt. Für die Versuche müssen daher zunächst Kristalle aus Proteinen herangezüchtet werden – ein schwieriges, oft auch unmögliches Unterfangen, das bei der Elektronenmikroskopie entfällt.
Originalpublikationen
Dong-Hua Chen, Damian Madan, Jeremy Weaver, Zong Lin, Gunnar F. Schröder, Wah Chiu, Hays S. Rye: Visualizing GroEL/ES in the Act of Encapsulating a Folding Protein. Cell 153, 1354–1365, June 6, 2013.
http://www.sciencedirect.com/science/article/pii/S009286741300528X
Benjamin Falkner, Gunnar F. Schröder: Cross-validation in cryo-EM–based structural modeling. PNAS 2013 (published ahead of print: May 14, 2013) DOI:10.1073/pnas.1119041110
Abstract: http://www.pnas.org/content/early/2013/05/14/1119041110.abstract
Weitere Informationen
Nachwuchsgruppe Computational Structural Biology: http://www.schroderlab.org/research.html
Institute of Complex Systems, Bereich Strukturbiochemie (ICS-6):
http://www.fz-juelich.de/ics/ics-6/
Ansprechpartner
Jun.-Prof. Gunnar F. Schröder, Institute of Complex Systems, Bereich Strukturbiochemie (ICS-6)
Tel. 02461 61-3259
gu.schroeder@fz-juelich.de
Pressekontakt:
Erhard Zeiss
Tel. 02461 61-1841
e.zeiss@fz-juelich.de
Media Contact
Weitere Informationen:
http://www.fz-juelich.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















