Ein Rezeptor in 3D
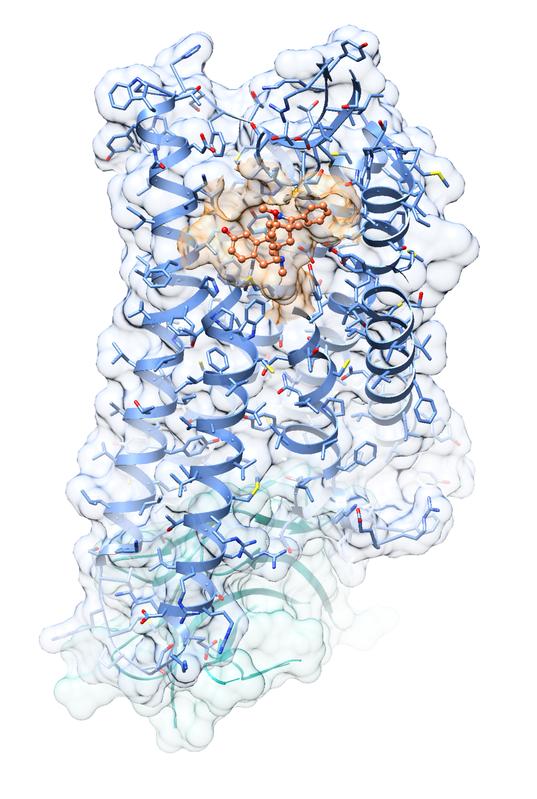
Im Bild ist die Kristallstruktur des μ-Opioidrezeptor-Agonist- Komplexes im Aktivzustand zu sehen (orange: Agonist BU72; blau: μ-Opioidrezeptor; türkis: G-Protein imitierender Nanobody). Grafik: Ralf Kling, FAU
Ein internationales Forscherteam, an dem pharmazeutische Chemiker der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) beteiligt sind, hat die dreidimensionale Molekülstruktur in der aktuellen Ausgabe der Fachzeitschrift Nature veröffentlicht.*
Das Ziel der Arbeitsgruppe, die vom Nobelpreisträger und Stanfordprofessor Brian Kobilka geleitet wird, ist es, zukünftig Wirkstoffe zu entwickeln, die passgenau diesen Rezeptor aktivieren.
Bereits seit Jahrtausenden gehören die Opiate zu den wichtigsten Heilmitteln. Sie werden zur Linderung schwerer und schwerster Schmerzen eingesetzt und sind deshalb für die Gesellschaft von unschätzbarem Wert. Wegen ihrer euphorisierenden und Abhängigkeit erzeugenden Wirkung zeigen Opiate, zu denen auch das Heroin gehört, jedoch auch verheerende Auswirkungen und können im Fall einer Überdosierung zum Tod durch Atemstillstand führen.
Trotz intensiver Forschung ist es bisher nicht gelungen, die Suchtwirkung der Opiate von den segensreichen schmerzstillenden Eigenschaften abzutrennen. So ist die Entwicklung nebenwirkungsfreier Schmerzmittel nach wie vor ein wichtiges Ziel der Pharmaforschung.
Seit einigen Jahren setzen Wissenschaftler ihre Hoffnungen auf das sogenannte strukturbasierte Design von Medikamenten. Dabei muss zuerst die genaue Struktur des Rezeptors bekannt sein, um dann einen Wirkstoff herstellen zu können, der wie ein Puzzleteil am Rezeptor andockt.
Dem internationalen Forscherteam, an dem Prof. Dr. Peter Gmeiner und Dr. Ralf Kling, Lehrstuhl für Pharmazeutische Chemie, mitarbeiten, ist es nun gelungen, die Kristallstruktur des μ-Opioidrezeptors – dem wichtigsten Angriffspunkt für starke Schmerzmittel auf Opiatbasis – dreidimensional darzustellen. Die gerade in der Zeitschrift Nature publizierte hochaufgelöste Kristallstruktur des μ-Opioidrezeptors gibt Anlass zu neuer Hoffnung für die Entwicklung effektiver und sicherer Schmerzmittel der Zukunft.
Ein detailliertes molekulares Verständnis der Wechselwirkung zwischen Wirkstoff und Rezeptor wird als Ausgangspunkt für das strukturbasiertes Design neuartiger Schmerzmittel überaus wertvoll sein. Diese sollen schmerzhemmende Signale erzeugen, die vom Rezeptor durch die Aktivierung des sogenannten G-Proteins ausgehen. Dagegen sollen Reize, die über die Bindung des Proteins β-Arrestin vermittelt werden, blockiert werden. Wirkstoffe dieser Art, die auch „biased ligands“ genannt werden, sind funktionell selektiv, da sie die gewünschte Wirkung auslösen ohne eine Nebenwirkung herbeizuführen.
Das Konzept dieser funktionell selektiven GPCR-Wirkstoffe ist über die Schmerzforschung hinaus mit großen Hoffnungen in der Pharmaindustrie verbunden. Auch in diese Forschungsaktivitäten ist das Team von Prof. Gmeiner involviert. So befasst sich die Arbeitsgruppe im Rahmen einer von den US-amerikanischen National Institutes of Health finanzierten Kooperation, die ebenfalls von Prof. Kobilka, Stanford University, koordiniert wird, mit der Entwicklung neuartiger Wirkstoffe auf der Basis aktueller, hochaufgelöster Rezeptor-Kristallstrukturen. Zudem gibt es an der FAU das Graduiertenkolleg GRK1910, das sich mit der strukturbasierten Erforschung neuer GPCR-Wirkstoffe befasst.
*doi: 10.1038/nature14886
Weitere Informationen für die Medien:
Prof. Dr. Peter Gmeiner
Tel.: 09131/85-24116
peter.gmeiner@fau.de
Media Contact
Weitere Informationen:
http://www.fau.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…





















