Chaperone halten das Tumorsuppressor-Protein p53 in Schach: Komplexer Regelkreis schützt vor Krebs
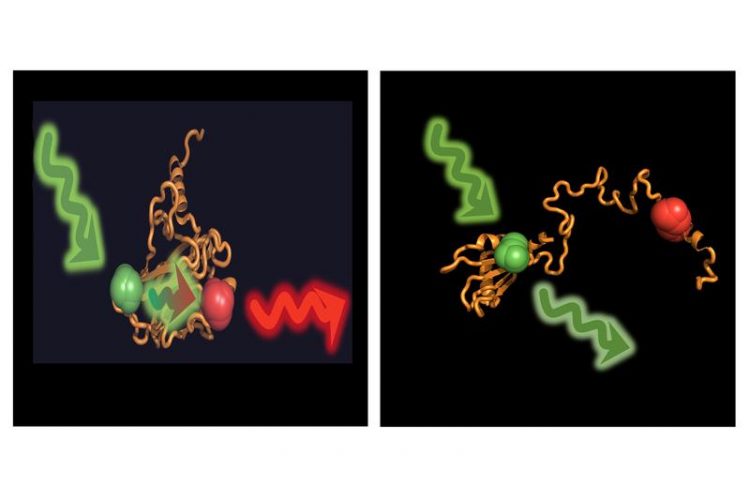
Ist das das Protein p53 gefaltet, kann der Donor eingestrahlte Energie auf den Akzeptor übertragen (links). Im aufgefalteten Zustand sind beide zu weit voneinander entfernt. G. Agam / LMU & V. Dahiya / TUM
Eine Krebstherapie ohne Nebenwirkungen, die gezielt nur Tumorzellen angreift – noch können Ärzte und Patienten davon nur träumen. Dabei hat die Natur ein solches gezieltes Anti-Tumor-Programm längst erfunden. Jede unserer Zellen ist damit ausgestattet:
Werden gravierende Schäden im Erbgut erkannt, zerstört sich die Zelle selbst und verhindert so das Wachstum des Tumors. Ein Münchner Forschungsteam hat jetzt den komplexen Regelungsmechanismus, an dem verschiedene Proteine beteiligt sind, entschlüsselt.
„Dass es einen solchen Regelungsmechanismus gibt, und dass dabei das Tumorsuppressor-Protein p53 eine Schlüsselrolle spielt, weiß man schon lange. Nicht bekannt war bisher, welche Rolle molekulare Chaperone bei der Regulation der zellulären Maschinerie spielen“, erklärt Prof. Johannes Buchner, Inhaber des Lehrstuhls für Biotechnologie an der TUM.
Blick in die molekulare Maschine
Diese Chaperone – der Name stammt aus dem Englischen und bedeutet „Anstandsdame“ – sind Proteine, die darüber wachen, dass sich andere Proteine richtig falten und damit funktionstüchtig sind. Im Labor konnten die Forscherinnen und Forscher zeigen, dass zwei Gruppen dieser Chaperon-Proteine, Hsp70, Hsp40 und Hsp90, die Funktion des Tumorsuppressor-Proteins p53 steuern, indem sie seine dreidimensionale Struktur beeinflussen.
Im Reagenzglas beobachteten die Biochemiker was passiert, wenn sie zu einer Lösung, die p53 enthält, die Chaperone Hsp40 und Hsp70 zugaben. p53 verlor dadurch seine Fähigkeit an DNA zu binden. Damit kam auch seine biologische Aktivität zum Erliegen.
Ein Leuchten offenbart die Struktur
Doch was steckt dahinter? Um diese Frage beantworten zu können, markierten die Wissenschaftlerinnen und Wissenschaftler p53 mit fluoreszierenden Farbstoffen. Damit konnten sie die Struktur einzelner p53 Moleküle vermessen.
p53 alleine liegt gefaltet vor, unter dem Einfluss von Hsp40 und Hsp70 wird es unter Energieverbrauch vollständig entfaltet. Den gegenteiligen Effekt hat die Zugabe des Chaperons Hsp90: Es überführt das entfaltete p53 wieder in die aktive, gefaltete Form.
„Dieser enorme Einfluss der Chaperone hat uns überrascht“, erinnert sich Buchner. „Die Zelle verfügt hier über einen äußerst komplexen Regelmechanismus, mit dem die Chaperone das Tumorsuppressor-Protein in Schach halten.“
Solange die molekularen Anstandsdamen zur Verfügung stehen, ist p53 entfaltet und biologisch inaktiv. Gerät die Zelle aber unter Stress und die Chaperone müssen an anderen Orten für Ordnung sorgen, faltet sich p53, heftet sich an die DNA und löst, wenn nötig, den zellulären Selbstmord aus.
Laut Buchner, könnte das Verständnis dieses molekularen Zusammenspiels in Zukunft mit
dazu beitragen, die Rolle der Proteine besser zu verstehen und neue Angriffspunkte für die Krebstherapie zu finden.
Mehr Informationen:
Die Struktur des p53 wurde mit Hilfe der Fluoreszenz Resonanz Energietransfer-Methode, kurz FRET, untersucht. Das Verfahren basiert darauf, dass an das Protein gebundene Farbstoffe mit Licht angeregt werden andere Farbstoffmoleküle, die im Abstand von wenigen Nanometern liegen, zum Leuchten bringen. Zusammen mit dem Team von Prof. Don Lamb an der Ludwig-Maximilians-Universität München konnten die Forscher auf diese Weise einzelne p53 Moleküle vermessen und beobachten, wie sich diese durch den Einfluss der Hsp40 und Hsp70 oder auch Hsp90 verändern.
Die Forschung wurde durch die Deutsche Forschungsgemeinschaft (SFB 1035 und die Exzellenzcluster Nanosystems Initiative Munich (NIM) und Center for Integrated Protein Science Munich (CiPSM)) unterstützt. Die Erstautorin wurde durch ein Postdoktorandenstipendium der Alexander von Humboldt-Stiftung gefördert.
Prof. Dr. Johannes Buchner
Lehrstuhl für Biotechnologie
Technische Universität München
Tel.: +49 89 289 – 13341
Johannes.Buchner@tum.de
Vinay Dahiya, Ganesh Agam, Jannis Lawatscheck, Daniel Andreas Rutz, Don C. Lamb, Johannes Buchner:
Coordinated conformational processing of the tumor suppressor protein p53 by the Hsp70 and Hsp90 chaperone machineries
Molecular Cell, April 23, 2019, DOI: 10.1016/j.molcel.2019.03.026
Link: https://www.sciencedirect.com/science/article/abs/pii/S1097276519302308
https://www.tum.de/nc/die-tum/aktuelles/pressemitteilungen/details/article/35454… Link zur Presseinformation
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















