Neue Methode erlaubt Einblicke in Proteinfunktion
Das Verfahren der FTIR-Differenzspektroskopie
Einem Photorezeptor bei der Arbeit zugeschaut RUB-Forscher in März-Ausgabe von „Nature structural biology"
Proteine bei der Arbeit zu beobachten ermöglicht ein neuer interdisziplinärer Ansatz, den Prof. Dr. Klaus Gerwert (Biophysik) und seine Mitarbeiter in den letzten Jahren an der RUB entwickelt haben: Sie nutzen statt der Röntgenstrukturanalyse die FTIR-Differenzspektroskopie und können so in Proteinen ablaufende Prozesse in Echtzeit von Nano (10-9) bis in den Sekundenbereich mit atomarer Auflösung beobachten. Die Anwendung ihrer Methoden am Photorezeptorprotein Photo Active Yellow proteine (PYP) beschreibt ein Artikel in der März-Ausgabe von NATURE Structural Biology. Ein „News and Views“-Kommentar dazu im gleichen Heft hebt die Innovation dieses Ansatzes für poststrukturelle Untersuchungen hervor.
Proteine als Nanomaschinen
Proteine sind vielseitige Nanomaschinen, die auf kleinstem Raum Arbeit leisten oder Stoffwechselvorgänge regeln. Forscher versuchen heute, Proteine, die in bestimmten physiologischen Vorgängen – z. B. bei der Krebsentstehung – die zentrale Rolle spielen, mithilfe des so genannten „Proteomic“-Ansatzes zu identifizieren. Ist ein Protein identifiziert, geht es anschließend darum, seine dreidimensionale Struktur auf atomarer Ebene zu entschlüsseln. Sie wird durch die Reihenfolge (Sequenz) der Protein-Bausteine, den Aminosäuren, gekennzeichnet. Die Struktur bestimmt die Funktion des Proteins. Eine falsch gefaltete Struktur kann fatale Folgen haben und z. B. Krankheiten auslösen. So diskutieren Wissenschaftler gegenwärtig die Rolle von falsch gefalteten Prionen-Proteinen bei der Entstehung von BSE bzw. der Creutzfeld-Jacob-Krankheit.
Eingefrorenes Bild mit der Röntgenstrukturanalyse
Zur Bestimmung von Proteinstrukturen setzten die Forscher bisher zumeist die Röntgenstrukturanalyse ein. Nachdem sie in den 50er-Jahren entwickelt wurde, wird sie heute beinahe automatisiert in „Strukturfabriken“ eingesetzt. Die Funktion der Proteine und zeitlich fein abgestimmten Interaktionen der Proteine kann die Methode allerdings in der Regel nicht zeigen. Bei Messzeiten von mehreren Stunden liefert sie konventionell nur ein Bild des eingefrorenen Grundzustands des Proteins. Neue Methoden sind also gefragt, um auch die Dynamik während der Aktion ansehen zu können. In speziellen Fällen konnten neuerdings auch 3D-Strukturen einzelner Zwischenstufen bestimmt werden. Dazu werden entweder bei der Cryo-Technik Zwischenstufen eingefroren (bis zu -200°C), oder die so genannte Laue-Technik an großen Synchrotron-Beschleuniger-Anlagen eingesetzt.
Lichtempfindliche Proteine
Gerwert und seine Mitarbeiter entwickelten jedoch eine andere Methode weiter, die zeitaufgelöste FTIR-Differenzspektroskopie, die zum ersten Mal von ihnen Ende der 80er-Jahre eingesetzt wurde. Sie ermöglichte zu verstehen, wie das Membranprotein Bakteriorhodopsin Protonen pumpt. Als Untersuchungsgegenstand dient jetzt ein PYP, ein Photorezeptor. Photorezeptorproteine enthalten eine chromophore Gruppe, d. h. eine Molekülgruppe, die Licht im sichtbaren Spektralbereich absorbiert. Nach der Anregung durch das Licht durchläuft diese Gruppe eine Konformationsänderung (Isomerisierung). Sie überträgt die Lichtanregung auf das Protein und löst so dessen Funktion aus. Im Fall von PYP handelt es sich um die Bindung eines weiteren Proteins, das das Signal in der Zelle weiterleitet. Das Bakterium regelt so sein Verhalten zum Licht: Es schwimmt zu energieliefernden Lichtquellen hin oder es meidet gefährliches UV-Licht. Auch das menschliche Auge enthält einen solchen Photorezeptor, das Rhodopsin. Die Beobachtung dieser Prozesse im Protein gelang nun der Arbeitsgruppe um Prof. Gerwert in Bochum zusammen mit der von Elisabeth Getzoff vom renommierten Scripps-Institut in La Jolla, Kalifornien.
Abbildungen im Netz
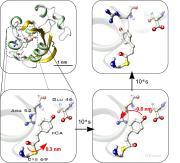
Nebenstehende Abbildungen erläutern das Verfahren. In Abb. 1 ist der Photorezeptor PYP dargestellt. Der lichtempfindliche Chromophor PCA ist in Abb. 2 vergrößert wiedergegeben. Die Untersuchungen zeigen eine schnelle Drehung des vorderen Teils um 0.3 nm (10-9m) in ns (10-9s). Anschließend bewegt sich der terminale Ring um 0.6nm und wird protoniert im mikrosekunden Bereich (Abb 4). Dadurch wird ein weiteres Protein gebunden, das eine Signalkette anregt. Die Prozesse sind in dieser „Nanomaschine“ präzise miteinander synchronisiert. Im weiteren Verlauf des Prozesses zeigte sich eine teilweise Entfaltung des Proteins, die mithilfe der Röntgenstrukturanalyse nicht zu sehen ist. Vermutlich behindert die für diese Methode notwendige Kristallisation des Proteins hier die konformelle Änderung. Besonders bei der Untersuchung von Membranproteinen stellt die Kristallisation eine Hürde dar. Da die FTIR Spektroskopie ohne Kristallisation auskommt und unter physiologischen Bedingungen Prozesse in Echtzeit aufnehmen kann, birgt sie ein großes Potenzial für poststrukturelle Genomuntersuchungen, in denen die Funktion von Proteinen und ihre Interaktionen in einem Netzwerk untersucht werden.
Weitere Informationen
Prof. Dr. Klaus Gerwert, Lehrstuhl für Biophysik, Fakultät für Biologie der Ruhr-Universität, 44780 Bochum, Tel. 0234/32-24461, Fax: 0234/32-14-238, Animationen unter http://www:bph.ruhr-uni-bochum.de
Weitere Informationen finden Sie im WWW:
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Neue universelle lichtbasierte Technik zur Kontrolle der Talpolarisation
Ein internationales Forscherteam berichtet in Nature über eine neue Methode, mit der zum ersten Mal die Talpolarisation in zentrosymmetrischen Bulk-Materialien auf eine nicht materialspezifische Weise erreicht wird. Diese „universelle Technik“…

Tumorzellen hebeln das Immunsystem früh aus
Neu entdeckter Mechanismus könnte Krebs-Immuntherapien deutlich verbessern. Tumore verhindern aktiv, dass sich Immunantworten durch sogenannte zytotoxische T-Zellen bilden, die den Krebs bekämpfen könnten. Wie das genau geschieht, beschreiben jetzt erstmals…

Immunzellen in den Startlöchern: „Allzeit bereit“ ist harte Arbeit
Wenn Krankheitserreger in den Körper eindringen, muss das Immunsystem sofort reagieren und eine Infektion verhindern oder eindämmen. Doch wie halten sich unsere Abwehrzellen bereit, wenn kein Angreifer in Sicht ist?…





















