Chemischer Trick gibt neue Einblicke in die Logistik der Zelle
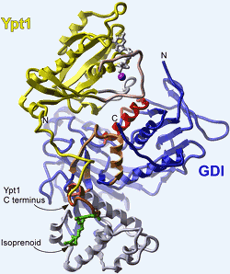
<br>Darstellung des Ypt1:GDI-Proteinkomplexes. Der Lipidrest (Isoprenoid) ist grün, das GDP grau und das damit assoziierte Magnesiumion magenta gefärbt. Domäne I von GDI ist in blau, Domäne II in blau-grau dargestellt. Bild: Max-Planck-Institut für molekulare Physiologie
Max-Planck-Wissenschaftlern entschlüsseln mit Hilfe halbsynthetischer Proteine, wie Zellen Rab-Transportproteine „recycelt“
Zellen von Pflanzen, Tieren und Menschen beherbergen eine Vielzahl abgeschlossener Räume (Kompartimente) bzw. Organellen, zwischen denen permanent ein hohes „Verkehrsaufkommen“ zu bewältigen ist. Eine wichtige Gruppe unter den „Verkehrslotsen“ in diesen Zellen sind die so genannten Rab/Ypt-Guanosin-Triphosphatasen (GTPasen), deren Funktion durch ein spezielles Inhibitor-Protein (RabGDI) gesteuert wird. Doch wie diese Verkehrsregelung und -sortierung in der Zelle im Detail funktioniert, war bisher nicht bekannt, da die Aufklärung der atomaren Struktur der beteiligten Proteine an technischen Problemen scheiterte. Jetzt ist es Wissenschaftlern des Max-Planck-Institut für molekulare Physiologie in Dortmund dank einer trickreichen Kombination aus chemischer Synthese und Protein-Engineering gelungen, den dabei entstehenden Proteinkomplex (Ypt1:RabGDI) „in Aktion“ herzustellen, zu kristallisieren und seine atomare Struktur mit einer Auflösung von 1,5 Angstrom zu bestimmen. Dank der nun vorliegenden Struktur ist auch klar, warum eine Mutante des Inhibitor-Proteins zu einer Form von geistiger Retardierung beim Menschen führt (Science, 24. Oktober 2003).
Die Zellen von Eukaryonten (Tiere, Pflanzen, u.a.)unterscheiden sich von Prokaryonten (Bakterien, Blaualgen und Mykoplasmen) unter anderem dadurch, dass sie in ihrem Inneren weitere, durch eine Membranhülle vom übrigen Zellraum abgegrenzte Kompartimente, wie z.B. einen Zellkern oder ein Mitochondrium, besitzen. Der Stoffaustausch zwischen diesen Kompartimenten erfolgt sehr gerichtet und koordiniert über den mehrstufigen Transport in Vesikeln. Eine wichtige Untergruppe jener Proteine, die zu diesem Transportsystem gehören, sind die GTP-bindenden Rab-Proteine (in Hefe: Ypt-Proteine), die in fast allen Kompartimenten einer Zelle zu finden sind. Diese Rab-Proteine können sich dank ihrer Modifizierung durch sogenannte Isoprenoidlipidreste (Geranylgeranylgruppen) mit den Membranen in der Zelle verbinden und auch wieder davon lösen.
Ein zentraler Regulator der GTP-bindenden Rab-Proteine (Rab/Ypt-GTPasen) ist RabGDI (GDI = GDP dissociation inhibitor). Er steuert die Verteilung der aktiven GTP- and der inaktiven GDP-bindenden Proteinformen zwischen den Membranen und dem Zytosol: Nur geranylgeranylierte, GDP-enthaltende Rab-Proteine können durch GDI an die Membranen geliefert bzw. von den Membranen wieder extrahiert werden. In der Hefe ist GDI ein essentielles Protein: Fehlt es, stirbt die Zelle. Beim Menschen führt eine bestimmte Mutation im alpha-RabGDI-Gen, die so genannte I92P-Mutante, bei der an Position 92 Isoleucin gegen Prolin vertauscht ist, zu einer Beeinträchtigung der geistigen Leistungsfähigkeit, der so genannten nicht-syndromischen geistigen Retardierung.
Deshalb haben sich Wissenschaftler seit vielen Jahren darum bemüht, die Struktur des Rab:RabGDI-Komplexes zu bestimmen. Leider gestaltete sich das extrem schwierig, da ausreichende Mengen der lipidierten Rab-Proteine nicht durch den mittlerweile klassisch gewordenen Ansatz der zellulären Überexpression hergestellt werden konnten. Um dieses Problem grundsätzlich zu lösen, haben jetzt Wissenschaftler vom Max-Planck-Institut für molekulare Physiologie verschiedene Methoden der synthetischen organische Chemie mit denen der Molekularbiologie kombiniert. Dieser „Methoden-Mix“ ermöglicht erstmals auch einen synthetischen Zugang zu den Hunderttausenden in der Natur vorkommenden Proteinen, indem kleinere – synthetisch oder natürlich hergestellte – Proteinfragmente durch „Ligation“ zu erheblich größeren Proteine zusammengeklebt werden können.
Mit Hilfe der chemisch/biochemischen Technik der „expressed protein ligation“ sind die Max-Planck-Forscher in der Lage, beliebige Modifikationen im synthetischen Teil des resultierenden Proteins einzuführen. Im vorliegenden Fall wurde ein verkürztes Rab-Protein aus Hefe (Ypt1) als Fusionsprotein mit einer so genannten Intein-Domäne durch Expression in E. coli-Bakterien hergestellt. Der Ypt1-Anteil des Fusionsproduktes wurde dann mit einem Thiol-Reagenz von dem Intein-Anteil abgespalten, so dass ein verkürztes Ypt1-Protein mit einem chemisch-reaktiven C-Terminus – einem Thioester – entstand. Danach konnte durch Reaktion („Ligation“) mit einem synthetisch hergestellten geranylgeranylierten Dipeptid der C-Terminus von Ypt1 in der nativen, mono-lipidierten Form generiert werden (Abbildung 2). Das nach diesem Schema synthetisierte geranylgeranylierte Ypt1 kristallisierten die Forscher dann als Komplex mit RabGDI aus Hefe-Zellen. Durch Röntgenbeugungsanalyse gelang es den Wissenschaftlern, die dreidimensionale Struktur dieses Protein-Komplexes mit einer räumlichen Auflösung von 1,5 A zu bestimmen (Abbildung 1).
Mit der Methode der Proteinligation hat sich das Repertoire der molekularbiologischen Grundlagenforschung erheblich erweitert: Im konkreten Fall der Rab-Proteine gelang es den Dortmunder Forschern damit erstmals, zum einen die Struktur eines Rab-Proteins aufzuklären, das nach der Übersetzung der Basenfolge seiner Boten-RNA noch modifiziert wurde. Zum anderen ergründeten die Wissenschaftler auch den Mechanismus, mit dem das Protein durch das Regulator-Protein GDI „erkannt“ wird. Denn aus dem Strukturvergleich des Proteinkomplexes mit einem nicht an GDI gebundenen Rab-Protein kann der spezifische Erkennungsmechanismus der GDP-Form direkt abgeleitet werden. Darüber hinaus wurde offensichtlich, warum sich die GDP-Dissoziation durch GDI verlangsamt. Ebenso wichtig wie auch überraschend sind die Details der Wechselwirkung mit dem lipidierten C-Terminus: So bindet der Lipidrest nicht an der früher vermuteten Stelle, sondern in Domäne II des GDI-Moleküls. Diese Bindungsstelle konnte an Hand der Struktur des freien GDIs nicht identifiziert werden, weil sie in diesem Molekül in der notwendigen Form noch nicht ausgebildet wird, sondern erst in dem Protein-Komplex durch Öffnung des hydrophoben Kerns von Domäne II geschaffen wird.
Die neuen Forschungsergebnisse helfen wesentlich, die Rolle der Rab-Proteine beim Vesikeltransport in der Zelle besser zu verstehen. So kann mit der jetzt vorliegenden Struktur modelliert werden, wie Rab-Proteine durch den Regulator RabGDI in Membranen ein- und ausgebaut werden. Die Proteinstruktur erklärt zudem, warum die schon erwähnte I92P-Mutante des GDI-Proteins die Rab-Proteine viel schlechter aus Membranen wieder extrahieren kann. Sie ermöglicht damit auch ein besseres Verständnis, worin zum Beispiel die molekularen Ursachen für die bereits erwähnte Form der geistigen Retardierung beim Menschen liegen und welche Ansätze für eine Therapie geeignet sein könnten.
Weitere Informationen erhalten Sie von:
Dr. Kirill Alexandrov
Max-Planck-Institut für molekulare Physiologie, Dortmund
Tel.: 0231 133-2356, Fax: -2399
E-Mail: kirill.alexandrov@mpi-dortmund.mpg.de
Media Contact
Weitere Informationen:
http://www.mpi-dortmund.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Merkmale des Untergrunds unter dem Thwaites-Gletscher enthüllt
Ein Forschungsteam hat felsige Berge und glattes Terrain unter dem Thwaites-Gletscher in der Westantarktis entdeckt – dem breiteste Gletscher der Erde, der halb so groß wie Deutschland und über 1000…

Wasserabweisende Fasern ohne PFAS
Endlich umweltfreundlich… Regenjacken, Badehosen oder Polsterstoffe: Textilien mit wasserabweisenden Eigenschaften benötigen eine chemische Imprägnierung. Fluor-haltige PFAS-Chemikalien sind zwar wirkungsvoll, schaden aber der Gesundheit und reichern sich in der Umwelt an….

Das massereichste stellare schwarze Loch unserer Galaxie entdeckt
Astronominnen und Astronomen haben das massereichste stellare schwarze Loch identifiziert, das bisher in der Milchstraßengalaxie entdeckt wurde. Entdeckt wurde das schwarze Loch in den Daten der Gaia-Mission der Europäischen Weltraumorganisation,…