"Protein-Nockenwelle" steuert Muskelmotor
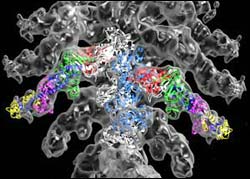
Rekonstruktion des Aktin-Myosin-Subfragments 1 mit den molekularen Modellen von Aktin und Myosin mit opaquer Oberflächendarstellung der 3D Rekonstruktion. Wichtig bei der Farbkodierung ist der rote und grüne Teil des Myosinfragments. Beide zusammen bilden die Bindungstasche des energieliefernden Nukleotids. Foto: Max-Planck-Institut für medizinische Forschung
Max-Planck-Forscher entdecken Steuerung für die Umwandlung biochemischer Energie in mechanische Arbeit in molekularen Motoren
In Muskeln sind Krafterzeugung und Energieumsatz über die Wechselwirkung spezieller Proteine miteinander gekoppelt. Mit Hilfe der Elektronenmikroskopie haben Wissenschaftler des Max-Planck-Instituts für medizinische Forschung, Heidelberg, jetzt ein notwendiges Steuerelement im Zyklus der Muskelproteine Aktin und Myosin bei der Muskelkontraktion gefunden. Damit gelang den Forschern ein entscheidender Durchbruch für unser Verständnis, wie die Energieumwandlung in Muskelfasern im Detail funktioniert (Nature, 25. September 2003).
Muskelfasern bestehen im wesentlichen aus zwei Typen von Filamenten, die aus dem Protein Aktin bzw. dem Protein Myosin aufgebaut sind. Die Muskelkontraktion wird durch eine Relativbewegung dieser Proteinfilamente (Gleitfilament-Mechanismus) hervorgerufen, wobei das „Aneinander-vorbei-Gleiten“ der Filamente durch die zyklische Wechselwirkung der Motor-Domänen der Myosin-Moleküle mit den Aktin-Filamenten bewirkt wird. Die Energie hierfür wird aus der Spaltung des Nukleotidmoleküls Adenosin-tri-phosphat (ATP) gewonnen.
Die Motordomäne des Myosins, auch Querbrücke genannt, durchläuft bei der Wechselwirkung mit dem Aktinfilament und dem Nukleotid dabei den sogenannten „Querbrückenzyklus“: Nach dem starken Binden der Querbrücke an ein Aktinfilament ändert sich ihre Konformation. Diesen Vorgang nennt man auch „power stroke“ oder „Ruderschlag“. Sie führt dazu, dass sich Myosin- und Aktinfilamente relativ zueinander bewegen. Gleichzeitig werden die Produkte der ATP-Spaltung (das Adenosin-di-phosphat ADP und anorganisches Phosphat) freigesetzt. Die Bindung eines neuen ATP-Moleküls an die Querbrücke leitet den nächsten Schritt im Zyklus ein: Durch das ATP verliert die Querbrücke ihre hohe Affinität zu dem Aktin-Filament und fällt von diesem ab. Das Nukleotid ATP wird dann gespalten und die Konformationsänderung der Querbrücke im „Ruderschlag“ wieder rückgängig gemacht. Danach kann die Querbrücke wieder an ein Aktinfilament binden und der Zyklus beginnt von Neuem.
Die molekularen Grundlagen dieses Zyklus waren bis heute nur teilweise verstanden. Durch Untersuchungen an Proteinkristallen mit Hilfe von Röntgenstrahlen war es zwar vor einigen Jahren gelungen, ein strukturelles Modell für den „Ruderschlag“ aufzustellen, doch weiterhin war nicht klar, warum das Binden einer Myosin-Querbrücke an das Aktin zugleich die Bindung der Spaltprodukte (ADP, Phosphat) schwächt bzw. warum umgekehrt das Binden eines neuen ATP-Moleküls seinerseits wiederum die Bindung der Querbrücke an das Aktin lockert. Doch dieses reziproke Verhalten ist extrem wichtig für das Funktionieren des Muskels. Ohne eine entsprechende Steuerung würde das Binden eines neuen ATP-Moleküls im Zyklus einfach nur eine Umkehrung des „power strokes“ bewirken; der Querbrückenzyklus des molekularen Motors liefe ins Leere.
Im Wettbewerb mit amerikanischen und japanischen Labors setzten die Heidelberger Max-Planck-Wissenschaftler auf die Elektronenmikroskopie, um den Komplex von Aktin und Myosin zu untersuchen. Normalerweise verwendet man bei solchen Strukturuntersuchungen eher kristallographische Methoden, doch lassen sich von den filamentösen Proteinen keine geeigneten Kristalle züchten. Die Forscher nutzten deshalb die Kryo-Elektronenmikroskopie, um die Proteine in einer freitragenden, nur etwa 50 – 100 Nanometer dicken Eisschicht abzubilden. Die Wissenschaftler erreichten eine sehr hohe strukturelle Auflösung (14 Angstrom) – dank neuer Methoden, die sie in den vergangenen zehn Jahren im Max-Planck-Institut für medizinische Forschung entwickelt hatten. Dazu gehörte der Einsatz neuer Elektronendetektoren, kombiniert mit der so genannten „energie-filternden Transmissionselektronenmikroskopie“, die nur Elektronen einer definierten Energie zur Abbildung verwendet. Dies erlaubt eine wesentlich kontrastreichere Abbildung der Probe und eine quantitative Interpretation des Bildkontrastes. Zusammen mit neu entwickelten Bildverarbeitungs- und Rekonstruktionsalgorithmen gelang ihnen so der Durchbruch.
Das auf diese Weise rekonstruierte dreidimensionale Modell des Komplexes verglichen die Wissenschaftler mit den röntgenkristallographisch gewonnenen Molekülstrukturen von Aktin (erstmalig am Heidelberger Max-Planck-Institut von K.C. Holmes und Mitarbeitern aufgeklärt) und Myosin (Modell der Arbeitsgruppe von I. Rayment, University of Wisconsin; USA). Konkret versuchten die Wissenschaftler, die bekannten Einzelstrukturen von Aktin und Myosin in ihr Modell des stark gebundenen, nukleotidfreien Proteinkomplexes einzupassen. Dabei entdeckten sie eine wesentliche Strukturänderung der Myosin-Querbrücke: Um das neue Modell und die Struktur der Einzelmoleküle zur Deckung zu bringen, musste diejenige Myosindomäne, die die Bindungsstellen für Aktin und für das Nukleotid verbindet, verdreht werden. In der Kristall-Einzelstruktur der Querbrücke schließt diese Domäne an die Nukleotidbindungsstelle an und bildet mit dem so genannten „switch-1“-Element die Bindungstasche für das Nukleotid ATP bzw. die Spaltungs-Endprodukte ADP und Phosphat. Durch die starke Bindung des Myosins an das Aktin wie sie jetzt in der vorliegenden Arbeit erstmals bei dieser Auflösung beschrieben wurde – dreht sich diese Domäne, um eine geeignete Bindungsfläche zum Aktin auszubilden. Als Konsequenz davon öffnet sich die Nukleotidbindungstasche. In diesem Moment befindet sich dann das Element „switch-1“ räumlich so weit entfernt vom Nukleotid, dass es nicht zu dessen Bindung beitragen kann.
Mit dieser Entdeckung lässt sich jetzt die wechselseitige Beeinflussung des Bindungsverhaltens von Aktin und Nukleotid an Myosin detailliert beschreiben: Durch die einfache Rotation einer Proteindomäne wird entweder die Aktin- oder die Nukleotid-Bindung bevorzugt. Da weiterhin ein energetischer und struktureller Unterschied besteht zwischen der Bindung eines noch energietragenden Nukleotids ATP und der Bindung der Spaltprodukte ADP und Phosphat, erklärt das nunmehr vorliegende Strukturmodell erstmals auch den geordneten, zeitlich gerichteten Ablauf der biochemischen Reaktionen im Muskelzyklus.
„Die Zeit war reif für diese Entdeckung,“ meint Rasmus R. Schröder, einer der Autoren der Studie in Nature. „Bereits seit mehr als zehn Jahren sind die Einzelstrukturen von Aktin und Myosin bekannt und viele Arbeitsgruppen haben in den letzten Jahren versucht, anhand der Kristallstrukturen von Myosin-Mutanten und Myosin-Isoformen einen Hinweis auf den molekularen Mechanismus dieses „aktin-aktivierten Nukleotidumsatzes“ zu erhalten.“ Tatsächlich erscheinen jetzt die Ergebnisse aus Heidelberg gemeinsam mit einer anderen Arbeit über eine solche Kristallstruktur (A. Houdusse und L. Sweeney) in Nature. Zusammen mit weiteren Fluoreszenz- und kinetischen Untersuchungen ergibt sich damit ein schlüssiges Bild des Querbrückenzyklus für den molekularen Motor Myosin. Aus der Analyse der Bewegung des „switch-1“ Elements ergibt sich jedoch noch eine weitere Schlussfolgerung, so Schröder, denn auch bei einem anderen molekularen Motor, dem Kinesin, kann man entsprechende Zustände dieses Strukturelements beobachten. Schroeder vermutet daher, dass die beschriebene Kopplung zwischen der Bindung des Motors an sein Partnerprotein und der Bindung und Spaltung des energieliefernden Nukleotids ATP bei Kinesin in vergleichbarer Weise besteht.
Weitere Informationen erhalten Sie von:
Dr. Rasmus R. Schröder
Max-Planck-Institut für medizinische Forschung, Heidelberg
Tel.: 06221 486 – 270
Fax.: 06221 486 – 437
E-Mail: Rasmus.Schroeder@mpimf-heidelberg.mpg.de
Prof. Kenneth C. Holmes
Max-Planck-Institut für medizinische Forschung, Heidelberg
Tel.: 06221 486 – 270
Fax.: 06221 486 – 437
E-Mail: Holmes@mpimf-heidelberg.mpg.de
Media Contact
Weitere Informationen:
http://www.mpimf-heidelberg.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















