Auf dem Weg zu neuen Wirkstoffen für die Stoffwechsel-Regulierung
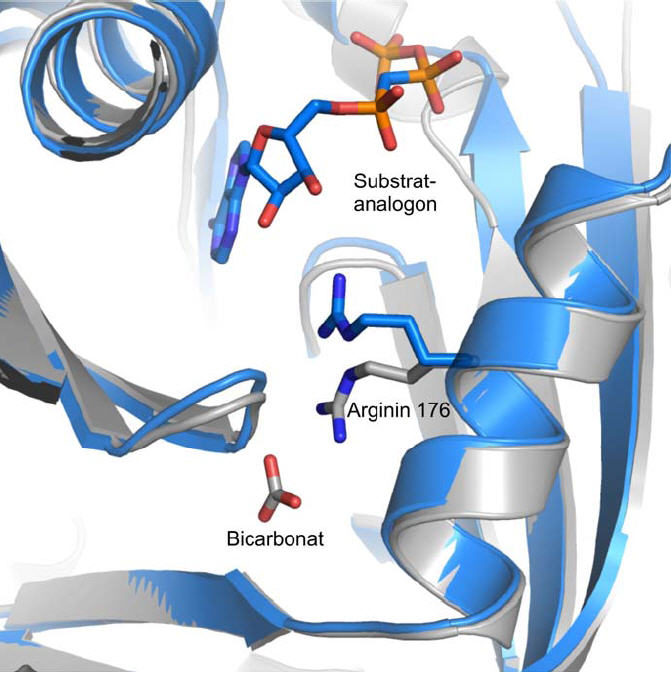
Ausschnitt aus den Strukturen des Enzyms sAC: Arginin 176 hat die Funktion eines Schalters. Wenn der Aktivator Bikarbonat an das Enzym bindet, wird der Schalter umgelegt und das Enzym aktiviert. Das Substrat ATP, aus dem der Botenstoff cAMP erzeugt wird, ist in der Grafik durch eine sehr ähnliche Substanz – ein Substanzanalogon – vertreten. Grafik S. 3: Lehrstuhl Biochemie, Universität Bayreuth; mit Quellenangabe zur Veröffentlichung frei.
Lebenswichtige Stoffwechselfunktionen im Organismus hängen davon ab, dass Signale durch chemische Botenstoffe übertragen werden. Zu diesen Botenstoffen zählt auch das cyclische Adenosinmonophosphat (cAMP). Dessen Entstehung wird durch Enzyme, unter anderem die lösliche Adenylatcyclase (sAC), gesteuert. Einer Forschungsgruppe um Prof. Dr. Clemens Steegborn an der Universität Bayreuth ist es gelungen, den Mechanismus, durch den das Enzym sAC aktiviert wird, strukturbiologisch aufzuklären. Diese Erkenntnisse bieten wertvolle Ansätze für die Entwicklung pharmakologischer Wirkstoffe, die den Botenstoff cAMP und damit indirekt eine Vielzahl von Stoffwechselfunktionen gezielt beeinflussen können.
Die Moleküle des Botenstoffs cAMP werden in den Zellen aus Adenosintriphosphat (ATP) erzeugt, das als zelleigener Energiespeicher bekannt ist. Enzyme ermöglichen und steuern diese Prozesse, indem sie die Rolle von Katalysatoren spielen. Dabei sind Adenylatcyclasen, die in der Zellmembran verankert sind, für die Synthese von cAMP an der Zellhülle zuständig. Damit cAMP überdies an verschiedenen Orten innerhalb der Zelle entsteht, wird lösliche Adenylatcyclase (sAC) benötigt. Dieses Enzym muss – wie auch alle anderen Adenylatcyclasen – aktiviert werden, bevor es als Katalysator wirksam werden kann.
Schon seit längerer Zeit ist bekannt, dass Bikarbonat das Enzym sAC aktiviert. Wie dieser Prozess im Einzelnen abläuft, hat erst jetzt die Forschungsgruppe um Prof. Steegborn am Lehrstuhl für Biochemie der Universität Bayreuth zutage gefördert. Sie hat dabei mit Pharmakologen an der Cornell University in New York eng zusammengearbeitet. In der neuen Ausgabe des renommierten Forschungsmagazins PNAS (Proceedings of the National Academy of Sciences of the United States of America) stellen die Wissenschaftler ihre Ergebnisse vor.
Strukturbiologische Erkenntnisse: Die Aktivierung des Enzyms sAC
Mittels strukturanalytischer Untersuchungen konnten sie präzise bestimmen, an welcher Stelle das Bikarbonat an das Enzym sAC andockt. Die Bindung an das Enzym sAC entsteht in unmittelbarer Nähe einer speziellen Aminosäure, die in der Biochemie als „Arginin“ bezeichnet wird. Sie stellt den 176ten Aminosäurebaustein des sAC-Moleküls dar und wirkt hier wie ein chemischer Schalter: Sie ändert ihre Struktur, sobald das Bikarbonat die Bindung an das sAC-Molekül eingegangen ist. Infolge dieser Strukturänderung ist der Weg frei für das Adenosintriphosphat (ATP): Es lagert sich so an das sAC-Molekül an, dass dieses seine Rolle als Katalysator übernimmt und diejenigen Prozesse auslöst, die aus ATP den Botenstoff cAMP erzeugen.
„Dieser Mechanismus bietet vielversprechende Anhaltspunkte für die pharmakologische Forschung“, freut sich Prof. Steegborn. „Denn wir wissen jetzt, wo genau neue Wirkstoffe ansetzen müssen, damit sie das Enzym sAC künstlich aktivieren und die Produktion des Signalüberträgers cAMP beeinflussen können.“
Ansätze für pharmakologische Wirkstoffe zur Stoffwechsel-Regulierung
Dabei stellt sich allerdings unter anderem das folgende Problem: Die Moleküle des Bikarbonats setzen sich aus nur wenigen Atomen zusammen. Bei den Molekülen pharmakologischer Wirkstoffe handelt es sich dagegen in der Regel um größere Komplexe. Deshalb ist es aus Platzgründen nicht sehr wahrscheinlich, dass sich Wirkstoffe entwickeln lassen, die auf exakt die gleiche Weise wie das Bikarbonat an das Enzym sAC andocken und seine katalytische Wirkung auslösen.
Doch auch für diese Herausforderung könnte sich bereits eine Lösung abzeichnen: Die Biochemiker in Bayreuth und New York haben bei ihren Strukturuntersuchungen herausgefunden, dass es eine der Bikarbonat-Bindestelle benachbarte Stelle des Enzyms sAC gibt, wo ein sogenannter Inhibitor eine Bindung eingehen kann; d.h. eine Substanz, welche die Wirkung des Enzyms unterdrückt. Es erscheint prinzipiell möglich, dass an derselben Stelle auch nicht-inhibierende Substanzen andocken. „Es wäre deshalb ein interessanter Ansatz für die weitere Forschung, Wirkstoff-Komplexe zu entwickeln, die doppelt an das sAC binden: einerseits dort, wo normalerweise das Biokarbonat als natürlicher Aktivator wirksam ist; und andererseits dort, wo sonst der Inhibitor Platz finden kann“, meint Prof. Steegborn. „Auf diese Weise stünde den Wirkstoffen eine große Bindungstasche für ausgiebige Interaktionen zur Verfügung, aber sie wären dennoch in der Lage, das Enzym zu aktivieren.“
Das Enzym sAC mit neuen Wirkstoffen zu aktivieren und somit die Erzeugung des Botenstoffs cAMP zu steuern, ist keineswegs ein Selbstzweck. Denn letztlich geht es darum, die durch den Botenstoff cAMP ausgelösten Stoffwechselprozesse möglichst zielgenau zu beeinflussen. Weil cAMP in verschiedenen Arten von Zellen unterschiedliche Aufgaben übernimmt, würde eine zielgenaue Beeinflussung dieser Stoffwechselprozesse allerdings voraussetzen, dass bereits das Enzyms sAC nicht generell, sondern nur in ausgewählten Arten von Zellen durch Wirkstoffe aktiviert wird.
Veröffentlichung:
Silke Kleinboelting, Ana Diaz, Sebastien Moniot, Joop van den Heuvel, Michael Weyand, Lonny R. Levin, Jochen Buck, and Clemens Steegborn,
Crystal structures of human soluble adenylyl cyclase reveal mechanisms of catalysis and of its activation through bicarbonate,
PNAS 2014 ; published ahead of print February 24, 2014
DOI: 10.1073/pnas.1322778111
Kurzporträt der Universität Bayreuth
Universität. Gründungsauftrag der 1975 eröffneten Universität ist die Förderung von interdiszipliden Schwerpunkten. Die Forschungsprogramme und Studienangebotedecken die Natur- und Ingenieurwissenschaften, die Rechts- und Wirtschaftswissenschaften sowie die Sprach-, Literatur und Kulturwissenschaften ab und werden beständig weiterentwickelt.
Gute Betreuungsverhältnisse, hohe Leistungsstandards, Fächer übergreifende Ko- operationen und wissenschaftliche Exzellenz führen regelmäßig zu Spitzenplatzie-rungen in Rankings. Die Universität Bayreuth belegt 2013 im weltweiten Times Higher Education (THE)-Ranking ‚100 under 50‘ als eine von insgesamt drei ver-tretenen deutschen Hochschulen eine Top-Platzierung.
Seit Jahren nehmen die Afrikastudien der Universität Bayreuth eine internationale Spitzenposition ein; die Bayreuther Internationale Graduiertenschule für Afrika-studien (BIGSAS) ist Teil der Exzellenzinitiative des Bundes und der Länder. Die Hochdruck- und Hochtemperaturforschung innerhalb des Bayerischen Geoinstituts genießt ebenfalls ein weltweit hohes Renommee. Die Polymerforschung ist Spit-zenreiter im Förderranking der Deutschen Forschungsgemeinschaft (DFG). Die Universität Bayreuth verfügt über ein dichtes Netz strategisch ausgewählter, inter-nationaler Hochschulpartnerschaften.
Derzeit sind an der Universität Bayreuth rund 13.000 Studierende in mehr als 100 verschiedenen Studiengängen an sechs Fakultäten immatrikuliert. Mit ca. 1.200 wissenschaftlichen Beschäftigten, davon 224 Professorinnen und Professoren, und rund 900 nichtwissenschaftlichen Mitarbeitern ist die Universität Bayreuth der größ-te Arbeitgeber der Region.
Media Contact
Weitere Informationen:
http://www.uni-bayreuth.de/presse/Aktuelle-Infos/2014/035-Enzym-Botenstoff.pdfAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ideen für die Zukunft
TU Berlin präsentiert sich vom 22. bis 26. April 2024 mit neun Projekten auf der Hannover Messe 2024. Die HANNOVER MESSE gilt als die Weltleitmesse der Industrie. Ihr diesjähriger Schwerpunkt…

Peptide auf interstellarem Eis
Dass einfache Peptide auf kosmischen Staubkörnern entstehen können, wurde vom Forschungsteam um Dr. Serge Krasnokutski vom Astrophysikalischen Labor des Max-Planck-Instituts für Astronomie an der Universität Jena bereits gezeigt. Bisher ging…

Wasserstoff-Produktion in der heimischen Garage
Forschungsteam der Frankfurt UAS entwickelt Prototyp für Privathaushalte: Förderzusage vom Land Hessen für 2. Projektphase. Wasserstoff als Energieträger der Zukunft ist nicht frei verfügbar, sondern muss aufwendig hergestellt werden. Das…





















