Abwehr von Viren oder Autoimmunerkrankung? Wenn das Phosphat entscheidet …
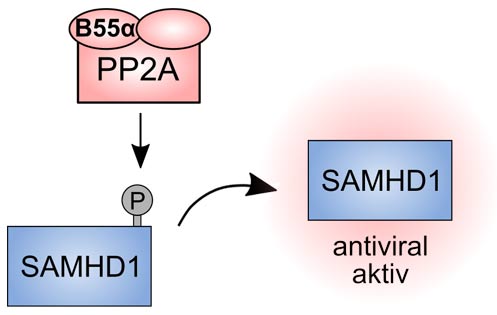
Schematische Darstellung der Dephosphorylierung des Restriktionsfaktors SAMHD1. Quelle: PEI
Restriktionsfaktoren hemmen in Körperzellen die Virusinfektion und -vermehrung (Replikation). SAMHD1 (sterile alpha motif and histidine-aspartate (HD)-domain-containing protein 1) ist ein solcher Restriktionsfaktor, der als wichtiges antiviral wirkendes Eiweiß bei HIV-1 (Humanes Immundefizienz-Virus 1) identifiziert wurde.
Doch SAMHD1 hat noch weitere Funktionen. So wurde gezeigt, dass Mutationen im SAMHD1-Gen mit dessen Funktionsverlust einhergehen und Krebs oder Autoimmunerkrankungen auslösen können. Entsprechend groß ist das Interesse an einem besseren Verständnis der Funktionsweise und Regulation dieses Moleküls.
SAMHD1 reguliert die in Zellen zur Verfügung stehende Menge wichtiger Bausteine für die Bildung der zellulären DNA, den dNTPs (Desoxynukleotidtriphosphaten). Durch Anhängen einer Phosphatgruppe (Phosphorylierung) an die Aminosäure an Position T592 wird SAMHD1 in die Lage versetzt, beim Prozess der DNA-Verdopplung ins Stocken geratene DNA-Abschnitte so zu beeinflussen, dass die DNA-Replikation (Verdopplung) fortgesetzt werden kann und es nicht zu einer chronischen Entzündung kommt. Im nicht phosphorylierten Zustand wirkt SAMHD1 dagegen antiviral.
Forscher um Dr. Renate König, Leiterin der Forschungsgruppe „Zelluläre Aspekte von Pathogen-Wirt-Interaktionen“ des Paul-Ehrlich-Instituts, haben untersucht, welche der vielen Phosphatasen der Zelle, die aufgrund ihrer Enzymaktivität Phosphatreste entfernen können, genau diese Dephosphorylierung bei Aminosäure T592 des SAMHD1 ausführen. Durch die Dephosphorylierung wird die antivirale Aktivität ermöglicht. Untersucht wurde auch, wie diese Reaktion zeitlich in den Zellzyklus eingebunden ist.
Hierzu verfolgten die Forscher zwei komplementäre „Proteomik“-Ansätze: Dies sind Verfahren, bei denen proteome – die Proteine betreffende – Analysen durchgeführt werden. Die Forscher untersuchten den Zellzyklus und den Einfluss der Phosphorylierungs- beziehungsweise Dephosphorylierungsprozesse auf die antivirale Wirkung von SAMHD1.
Dabei identifizierten sie das Schlüsselenzym, das die antivirale Aktivität des SAMHD1 ermöglicht, nämlich die Phosphatase PP2A-B55alpha. Sie verdankt ihren kryptische Namen dem Umstand, dass es 90-Enzymvarianten (Holoenzyme) gibt, aber nur genau die eine Variante mit der Bezeichnung PP2A-B55alpha die SAMHD1-Dephosphorylierung und damit dessen antivirale Aktivität vermitteln kann. Zudem ist es den Forschern gelungen, ein Zeitfenster im Zellzyklus zu entdecken, in dem diese Dephosphorylierung geschieht und somit die Effizienz der HIV-Infektion verringert ist.
Während die phosphorylierte SAMHD1-Variante bei der Zellteilung eine wichtige Rolle spielt und mit dazu beiträgt, chronische Entzündungen zu verhindern, ist das Molekül ohne diese Phosphatgruppe in der Lage, Viren wie HIV oder das Hepatitis-Virus abzuwehren.
In weiteren Untersuchungen wollen die Forscher aufklären, auf welche Weise SAMHD1 die HIV-Infektion abwehren kann.
Originalpublikation
Schott K, Fuchs NV, Derua R, Mahboubi B, Schnellbächer E, Seifried J, Tondera C, Schmitz H, Shepard C, Brandariz-Nuñez, Diaz-Griffero F, Reuter A, Kim B, Janssens V, König R (2018): Dephosphorylation of the HIV-1 restriction factor SAMHD1 is mediated by PP2A-B55α holoenzymes during mitotic exit.
Nat Commun 9, Article number: 2227 (2018), Jun 8
DOI: 10.1038/s41467-018-04671-1
Das Paul-Ehrlich-Institut in Langen bei Frankfurt am Main ist als Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel eine Bundesoberbehörde im Geschäftsbereich des Bundesministeriums für Gesundheit (BMG). Es erforscht, bewertet und lässt biomedizinische Human-Arzneimittel und immunologische Tierarzneimittel zu und ist für die Genehmigung klinischer Prüfungen sowie die Pharmakovigilanz – Erfassung und Bewertung möglicher Nebenwirkungen – zuständig.
Die staatliche Chargenprüfung, wissenschaftliche Beratung/Scientific Advice und Inspektionen gehören zu den weiteren Aufgaben des Instituts. Unverzichtbare Basis für die vielseitigen Aufgaben ist die eigene experimentelle Forschung auf dem Gebiet der Biomedizin und der Lebenswissenschaften.
Das Paul-Ehrlich-Institut mit seinen rund 800 Mitarbeiterinnen und Mitarbeitern nimmt zudem Beratungsfunktionen im nationalen (Bundesregierung, Länder) und internationalen Umfeld (Weltgesundheitsorganisation, Europäische Arzneimittelbehörde, Europäische Kommission, Europarat und andere) wahr.
https://www.nature.com/articles/s41467-018-04671-1 – Volltext der Publikation (Open Access)
https://www.pei.de/DE/infos/presse/pressemitteilungen/2018/10-abwehr-von-viren-o… – Diese Pressemitteilung auf den Seiten des Paul-Ehrlich-Instituts
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Bakterien für klimaneutrale Chemikalien der Zukunft
Forschende an der ETH Zürich haben Bakterien im Labor so herangezüchtet, dass sie Methanol effizient verwerten können. Jetzt lässt sich der Stoffwechsel dieser Bakterien anzapfen, um wertvolle Produkte herzustellen, die…

Batterien: Heute die Materialien von morgen modellieren
Welche Faktoren bestimmen, wie schnell sich eine Batterie laden lässt? Dieser und weiteren Fragen gehen Forschende am Karlsruher Institut für Technologie (KIT) mit computergestützten Simulationen nach. Mikrostrukturmodelle tragen dazu bei,…

Porosität von Sedimentgestein mit Neutronen untersucht
Forschung am FRM II zu geologischen Lagerstätten. Dauerhafte unterirdische Lagerung von CO2 Poren so klein wie Bakterien Porenmessung mit Neutronen auf den Nanometer genau Ob Sedimentgesteine fossile Kohlenwasserstoffe speichern können…





















